При изменении внешних условий равновесие реакции смещается таким образом, чтобы уменьшить это воздействие.
Смещение равновесия при изменении температуры. В случае экзотермической реакции (протекающей с выделением тепла) равновесие смещается влево (в сторону исходных веществ) при повышении температуры, и вправо (в сторону продуктов реакции) при понижений температуры: |

В случае эндотермической реакции (протекающей с поглощением тепла) равновесие смещается вправо при повышении температуры и влево при понижении температуры:

Смещение равновесия при изменении давления.
Если реакция протекает с увеличением числа молекул газообразных веществ, при повышении давления равновесие смещается влево, а при понижении давления вправо:

Если реакция протекает с уменьшением числа молекул газообразных веществ, то при повышении давления равновесие смещается вправо, а при понижений давления влево:

Если реакция протекает без изменения числа молекул газообразных веществ, то при изменении давления равновесие не смещается:
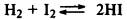
Билет №7.2 Реакция ионного обмена. Условия их необратимости.
В растворах электролитов реакции протекают между ионами.
Реакции ионного обмена — окислительно-восстановительная реакция, которая идет в направлении связывания ионов, но при которой не происходит изменения степеней окисления.
Условия течения реакций в растворах электролитов до конца:
1) в результате реакции выпадает осадок:
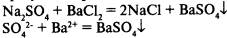
2) в результате реакции выделяется газ:

3) в результате реакции образуется малодиссоциирующее вещество:

Ионный обмен – это процесс, в результате которого ионы, находящиеся в твердой фазе. обмениваются с ионами, находящимися в растворе. Нерастворимое твердое вещество может представлять собой какой-либо природный материал либо синтетическую смолу. Природные материалы, используемые для ионного обмена, включают цеолиты (комплексные алюмосиликаты натрия) и глауконитовый песок.
На поверхности этих твердых веществ имеются электрически заряженные центры, расположенные на более или менее регулярном расстоянии друг от друга. Эти центры удерживают на себе простые ионы с зарядами противоположного знака. Именно эти ионы обмениваются с другими ионами, содержащимися в растворе.
Катионообменники. Катионообменные материалы состоят из трех частей:
1) основная масса, или скелет, обычно обозначаемый символом R–;
2) активные центры (такие группы, как —  либо —
либо —  );
);
3) катионы, подлежащие обмену (обычно это ионы Н+ или Н3О+).
Когда твердый катионообменник приходит в соприкосновение с раствором, в котором содержатся какие-либо ионы, между ними устанавливается равновесие. Например,
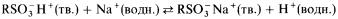
Если первоначально раствор содержит, например, хлорид натрия, то ионы натрия обмениваются с ионами водорода и из нижней части колонки вытекает разбавленный раствор соляной кислоты.
Ионообменный материал можно регенерировать (восстанавливать), промывая колонку разбавленной соляной кислотой. Это приводит к смещению влево рассматриваемого равновесия, в результате чего ионы натрия замещаются ионами водорода.
Анионообменники. Анионообменник удаляет из раствора анионы. Типичным примером анионного обмена является следующее равновесие:

Для регенерации анионообменника может использоваться какое-либо основание, например раствор гидроксида натрия. Это сдвигает указанное равновесие влево.
Билет №8.1 Скорость химических реакций. Факторы, влияющие на скорость химическойреакции (зависимость скорости от природы, концентрации вещества, площадиповерхности соприкосновения реагирующих веществ, температуры,катализатора). Скоростью химической реакции называется изменение количества вещества за единицу времени в единице объема. Скорость реакции зависит от природы реагирующих веществ. При реакции металлов с соляной кислотой, чем левее расположен металл враду напряжений, тем быстрее протекает реакция, а металлы, находящиесяправее водорода, не реагируют вообще: Скорость реакции увеличивается при увеличении концентрации реагирующихвеществ. Горение веществ в чистом кислороде происходит быстрее, чем в воздухе,содержание кислорода в котором составляет 21%: Скорость реакции увеличивается при увеличении поверхностисоприкосновения реагирующих веществ. Железные опилки быстрее реагируют с соляной кислотой, чем железныегвозди: Скорость реакции увеличивается с увеличением темпера- Железо при обычной температуре реагирует с хлором очень медленно, привысокой же температуре протекает бурная реакция (железо горит в хлоре): Водород восстанавливает оксиды металлов при нагревании, при комнатнойтемпературе эта реакция не идет, то есть ее скорость равна 0: Скорость многих реакций увеличивается в присутствии специальныхвеществ — катализаторов. Катализаторы увеличивают скорость реакции, но по окончании реакцииостаются неизменными. Примеры каталитических реакций: (реакция сильно ускоряется в присутствии МnО2). (реакция протекает только в присутствии катализаторов — платины,оксида ванадия (V), железа и др).
Билет №9.1 Общая характеристика металлов главных подгрупп I – III групп (I-A – III-Aгрупп) в связи с их положением в периодической системе химических элементовД. И. Менделеева и особенности строение их атомов, металлическая химическаясвязь, химические свойства металлов как восстановителей. В периодической системе элементов металлы в основном располагаются вглавных подгруппах I—Ill групп, а также в побочных подгруппах. В IA группе у атомов элементов на внешнем энергетическом уровненаходится 1 электрон в состоянии s1, во IIA группе у атомов на внешнем ЭУ 2электрона в состоянии s2. Эти элементы относятся к s-элементам. В IIIAгруппе у всех элементов на внешнем ЭУ 3 электрона в состоянии s2p1. Ониотносятся к p-элементам. В IA группу входят щелочные металлы Li, Na, K, Rb, Cs, Fr, активностькоторых при движении сверху вниз увеличивается вследствие увеличениярадиуса атомов, металлические свойства возрастают также, как и ущелочеземельных металлов IIA группы Be, Mg, Ca, Sr, Ba, Ra и металлов IIIAгруппы Al, Ga, In, Tl. Оксиды типа R2O характерны только для Li, для всех остальных щелочныхметаллов характерны пероксиды R2O2, которые являются сильными окислителями. Все металлы этих групп образуют основные оксиды и гидроксиды, кроме Beи Al, которые проявляют амфотерные свойства. Химические свойства. Атомы металлов имеют больший радиус, чем атомынеметаллов, поэтому легко теряют валентные электроны. Вследствие этогометаллы проявляют восстановительные свойства.
Билет №10.1 Общая характеристика неметаллов главных подгрупп IV – VII групп (IV-A – VII-A) в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Изменение окислительно-восстановительных свойств неметаллов на примере элементов VI-A группы. При движении сверху вниз по группам увеличивается радиус атома иследовательно уменьшаются окислительные свойства. Сравнительная характеристика окислительно-восстановительных свойствнеметаллов на примере кислорода и серы. Схемы электронных оболочек: На внешнем электронном уровне атомов кислорода и серы находится по 6электронов. У кислорода окислительные свойства выражены сильнее, так как радиусатома меньше и валентные электроны сильнее притягиваются к ядру. Длякислорода наиболее характерна степень окисления —2, проявляющаяся придостройке внешнего энергетического уровня до 8 электронов. Сера также может являться окислителем, проявляя степень окисления —2,но характерны также степени окисления +4 (при потере 4 р-электронов) и +6(при потере всех шести валентных электронов). В реакциях с металлами кислород и сера проявляют окислительныесвойства, образуя оксиды и сульфиды соответственно: В реакциях с неметаллами кислород проявляет свойства окислителя: Сера может быть как окислителем так и восстановителем: Сера выступает в роли восстановителя в реакции с концентрированнойазотной кислотой:
Билет №11.1 Аллотропия веществ, состав, строение, свойства аллотропных модификаций. Если какой-либо элемент может существовать в двух или несколькихтвердых формах (кристаллических либо аморфных), то считается, что онпроявляет аллотропию. Различные формы одного элемента называютсяаллотропами. Аллотропы существуют приблизительно у половины всех элементов. Например, углерод существует в виде алмаза либо графита. Серасуществует в двух кристаллических формах - ромбической и моноклинной - взависимости от температуры. Обе ее кристаллические формы являются примерамимолекулярных кристаллов. Молекулы в них представляют собой гофрированныециклы, в каждом из которых содержится по восемь ковалентно связанных атомовсеры. Твердая сера может существовать еще в третьей аллотропной форме какпластическая сера. Эта форма серы неустойчива. Она состоит из длинныхцепочек атомов серы, которые при комнатной температуре разрушаются и сноваобразуют молекулы S8, кристаллизующиеся в ромбическую решетку. Фосфор может существовать в трех аллотропных формах. Наиболееустойчивая из них-красный фосфор. Красный фосфор имеет каркаснуюкристаллическую структуру, в которой каждый атом ковалентно связан с тремядругими атомами фосфора. Белый фосфор представляет собой молекулярныйкристалл. Каждая его молекула содержит четыре атома фосфора, ковалентносвязанных в тетраэдричес-кую структуру. Третий аллотроп - черный фосфор -образуется только при высоких давлениях. Он существует в видемакромолекулярной слоистой структуры.
Билет №12.1 Электролиз растворов и расплавов солей (на примере хлорида натрия). Электролизом называются реакции в растворах или расплавах электролитов, происходящие под действием электрического тока. В расплавах или растворах происходит диссоциация электролита. Катионысмещаются к катоду, анионы — к аноду. Электролиз расплавов. На катоде происходит восстановление катионов, нааноде — окисление анионов. Электролиз расплава хлорида натрия. На катоде восстанавливаютсякатионы Na+ и выделяется металлический натрий, на аноде окисляются хлорид-ионы и выделяется хлор: Электролиз водных растворов. В процессах на катоде и аноде могутучаствовать не только ионы электролита, но и молекулы воды. Будут ли на катоде восстанавливаться катионы металла или молекулыводы, зависит от положения металла в ряду напряжений металлов. Если металл находится в ряду напряжений правее водорода, на катодевосстанавливаются катионы металла; если металл находится в ряду напряженийлевее водорода, на катоде восстанавливаются молекулы воды и выделяетсяводород. Наконец, в случае катионов металлов от цинка до свинца можетпроисходить либо выделение металла, либо выделение водорода, в зависимостиот концентрации раствора и других условий. На аноде также может происходить либо окисление анионов электролита,либо окисление молекул воды. При электролизе солей бескислородных кислотили самих кислот на аноде окисляются анионы (кроме F–.) В случаекислородсодержащих кислот на аноде окисляются молекулы воды и выделяетсякислород. Электролиз раствора хлорида натрия. На катоде восстанавливаютсямолекулы воды и выделяется водород, а на аноде окисляются хлорид-ионы ивыделяется хлор: Электролиз раствора нитрата серебра. На катоде восстанавливаютсякатионы Ag+ и выделяется серебро, на аноде окисляются молекулы воды ивыделяется кислород: Применение. Электролиз расплавов используют для получения фтора,активных металлов (натрий, калий, магний, кальций, алюминий). Электролизрастворов используют для получения хлора, щелочей, очистки металлов(электрорафинирование).
Билет №13.1 Валентность и степень окисления химических элементов
Современные представления о природе химической связи основаны на электронной теории валентности. Согласно этой теории, атомы, образуя химические связи, стремятся к достижению наиболее устойчивой электронной конфигурации (имеет наименьшую энергию).
Электроны, принимающие участие в образовании химической связи, называются валентными. Валентность атома определяется числом его неспаренных электронов, участвующих в образовании химических связей с другими атомами, а также числом обобществленных электронных пар в ковалентных соединениях. Валентность всегда выражается небольшими целыми числами.
Различают атомы элементов, имеющих постоянную валентность: H, Na, Ca, Al и др., и атомы элементов, проявляющих переменную валентность: C, S, Cl, Cu и т.д. Переменная валентность связана с возможностью распаривания и спаривания электронов (обычно в пределах одного энергетического уровня). Энергия, затраченная на распаривание электронов в пределах одного энергетического уровня, как правило, полностью компенсируется энергией, выделяющейся при образовании дополнительных химических связей.
Но в соединении электроны, образующие химическую связь, смещены к наиболее электроотрицательному атому, и, следовательно, он приобретает определенный отрицательный заряд. В соответствии с этим определением введено понятие степени окисления; оно облегчает установление формул соединений элементов, существующих в нескольких валентных состояниях и полезно при составлении уравнений окислительно – восстановительных реакций.
Степенью окисления называется формальный заряд атома в молекуле, вычисленный исходя из предположения, что все связи атомов в молекуле ионные. Понятие степени окисления имеет чисто условный характер и не отвечает реальному распределению зарядов между атомами в молекуле. В органической химии понятие степени окисления обычно не используется.
Для вычисления степени окисления элемента в соединении следует исходить из следующих положений:
1) степени окисления элементов в простых веществах принимаются равными нулю;
2) алгебраическая сумма степеней окисления всех атомов в соединении (с учетом числа атомов), равна нулю;
3) постоянная степень окисления в соединениях проявляют щелочные металлы (+1), металлы главной подгруппы II группы, цинк (+2), алюминий (+3) и кадмий (+2);
4) водород проявляет степень окисления +1 во всех соединениях, кроме гидридов металлов NaH, CaH2 и т.п., где его степень окисления равна -1;
5) степень окисления кислорода в соединениях равна -2, за исключением пероксидов (-1) и фторида кислорода OF2 (+2).Билет №14.1 Высшие оксиды химических элементов третьего периода. Закономерности визменении их свойств в связи с положением химических элементов впериодической системе Д. И. Менделеева. Характерные химические свойстваоксидов: основных, амфотерных, кислотных. Реакционная способность элементов во взаимодействии с кислородом,вообще говоря, уменьшается при перемещении вправо вдоль каждого периода.Например, в 3-м периоде два s-металла, натрий и магний, и два р-элемента,алюминий и фосфор, бурно реагируют с кислородом, образуя оксиды. В том жепериоде элементы кремний и сера способны только медленно реагировать скислородом. Хлор и аргон, расположенные в правом конце периода, вообще нереагируют с кислородом. Электроположительные s-металлы образуют ионные оксиды, как, например,оксид натрия Na2O и оксид магния MgO. Оксиды элементов, расположенных всредней и правой частях периода, являются преимущественно ковалентнымисоединениями, как, например, оксиды азота и серы. Кислотно-основный характер оксидов тоже изменяется от основного уоксидов элементов левой части периода к амфотерному у оксидов элементовсредней части периода и далее к кислотному у оксидов элементов правой частипериода. Например, s-металлы обычно образуют оксиды, которые растворяются вводе с образованием щелочных растворов: Молекулярные оксиды р-элементов, например диоксид углерода и триоксидсеры, обычно обладают кислотными свойствами. Закономерное изменениеосновных свойств с переходом к кислотным свойствам наглядно проявляется уоксидов элементов 3-го периода.
Билет №15.1 Кислоты, их классификация и химические свойства на основе представлений обэлектролитической диссоциации. Кислота — сложное вещество, при диссоциации которого образуется только один тип катионов — ионы водорода. Классификация кислот. Соляная кислота — водный раствор газа хлоро-водорода в воде. Химические свойства. Кислоты изменяют цвет индикаторов: лакмусокрашивается в красный цвет, метилоранж — в желтый. При реакции с основаниями образуется соль и вода (реакциянейтрализации). В реакцию вступают как растворимые, так и нерастворимые вводе основания: При реакции с основными оксидами образуются со ли: Кислоты реагируют с металлами, находящимися в ряду напряжений доводорода, при этом выделяется газообразный водород и образуется соль: Сильные кислоты реагирует с солями слабых кислот, вытесняя слабыекислоты из их солей: Получение кислот. Многие кислоты можно получить при реакции кислотныхоксидов с водой: Концентрированная серная кислота при обычной температуре не действуетна многие металлы. По этой причине, например, безводная серная кислота вотличие от её растворов может сохраняться в железной таре. Но концентрированная серная кислота действует почти на все металлы принагревании. При этом образуются соли серной кислоты, однако водород невыделяется, а получаются другие вещества, например сернистый газ. Так, при нагревании концентрированной серной кислоты с медью вначалесерная кислота окисляет медь до окиси меди, а сама восстанавливается приэтом до сернистой кислоты, которая тотчас же разлагается на сернистый газ иводу: Образовавшаяся окись меди реагирует с избытком серной кислоты, образуясоль и воду: Таким образом, окись меди является промежуточным веществом в этойреакции. Сложив эти уравнения, мы получим итоговое уравнение реакции, вкоторое входят только исходные и конечные вещества:
Билет №16.1 Основания, их классификация и химические свойства на основе представленийоб электролитической диссоциации. Основания — электролиты, при диссоциации которых образуется только один вид анионов — гидроксид-ионы. Классификация оснований 1. Растворимые в воде (щелочи) — гидроксиды металлов главных подгруппI и II групп. 2. Нерастворимые в воде — гидроксиды остальных металлов. Химические свойства. Щелочи изменяют окраску индикаторов (лакмусстановится синим, фенолфталеин – малиновым). Взаимодействие с кислотами: Взаимодействие с кислотными оксидами: Растворы щелочей вступают в реакции ионного обмена с растворами солей,если образующийся при этом гидроксид нерастворим в воде: При нагревании слабые основания разлагаются на оксиды металлов и воду: Получение оснований. Щелочи получают электролизом растворов солей. Электролиз раствора хлорида натрия. Процессы на катоде и аноде: Уравнение реакции: Нерастворимые в воде основания получают реакцией обмена со щелочами:
Билет №17.1 Средние соли, их состав, названия, химические свойства (взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакцийокисления-восстановления и ионного обмена). Соли — электролиты, в растворах которых есть катионы металлов или ион аммония и анионы кислотных остатков. Названия: название аниона + название катиона в родительном падеже +степень окисления металла. 1.B водных растворах соли могут реагировать со щелочами. Так,хлористый магний MgCl2 взаимодействует с едким натром, образуя новую соль иновое основание: 2. Соли могут реагировать с кислотами. Так, раствор азотнокислогобария Ва(гЮз)а взаимодействует с раствором серной кислоты, образуя новуюкислоту и новую соль: З.В водных растворах соли могут реагировать между собой. Если слить вместе водные растворы хлористого кальция CaCl2 яуглекислого натрия Na2CO3 TO тотчас же образуется белый осадокнерастворимого в воде углекислого кальция СаСО3, а в растворе — хлористыйнатрий: 4. В водных растворах солей металл, входящий в их состав, можетзамещаться другим металлом, стоящим до него в ряду активности. Если в раствор сернокислой меди опустить чистую железную проволоку иликусочек цинка, то на их поверхности выделяется медь, а в раствореобразуется сернокислое железо (если было опущено железо) или сернокислыйцинк (если был опущен цинк): Но из сернокислого цинка нельзя вытеснить цинк медью: медь в рядуактивности стоит после цинка.
Билет №18.1 Гидролиз солей (разобрать первую стадию гидролиза солей, образованныхсильным основанием и слабой кислотой, слабым основанием и сильнойкислотой). Взаимодействие ионов соли с водой, в результате которого образуются малодиссоциирующие соединения (ионы или молекулы), называют гидролизом соли Четыре типа солей, которые по-разному взаимодействуют с водой. I. Соль образована сильным основанием и сильной кислотой. NaCI + НОН — ни один из ионов соли с водой не вза-имодействет. Реакциясреды нейтральная. II. Соль образована сильным основанием и слабой кислотой. [pic]- реакция среды щелочная. Гидролиз солей, образованных сильным основанием и слабой кислотой,заключается в присоединении анионами кислотного остатка ионов водорода инакоплении в растворе гидроксид-ионов, образующихся при диссоциации воды. Теперь выясним, почему раствор хлорида алюминия приобрел кислуюреакцию среды. В растворе АlСl3 диссоциирует на ионы: Столкновение ионов Н+ и С– к образованию соединения не приводит. Изимеющихся в растворе ионов малодиссоциирующий продукт образуют ионы Аl3+ иОН–. Связывание ионов ОН– в малодиссоциирующий ион АlOН2+ (К= 1,38 • 10–9)вызывает дальнейший распад молекул воды на ионы: Таким образом, в растворе хлорида алюминия осуществляется реакция, врезультате которой появляется избыток ионов Н+, т. е. раствор приобретаеткислую реакцию. Подобным образом ведут себя в растворах все соли,образованные слабым основанием и сильной кислотой. III. Соль образована слабым основанием и сильной кислотой. реакция среды кислая. Гидролиз соли, образованной слабым основанием и сильной кислотой,заключается в присоединении катионами металла гидроксид-ионов и накоплениив растворе ионов водорода, образующихся при диссоциации воды. Гидролизхлорида алюминия можно выразить уравнением реакции:IV. Соль образована слабым основанием и слабой кислотой.Реакция среды зависит от сравнительной силы кислоты и основания. Внекоторых случаях гидролиз идет до конца:
Билет №19.1 Коррозия металлов (химическая и электрохимическая). Способы предупреждениякоррозии. Разрушение металлов и сплавов вследствие химического взаимодействия их с окружающей средой называются коррозией металлов. Коррозию, вызванную непосредственным химическим взаимодействием между металлом и окружающей средой, называют химической коррозией.Химическая коррозия — окисление металла без возникновениягальванической пары. Газовая коррозия — при t > 600°С:Коррозию, сопровождающуюся возникновением электрического тока за счет появления гальванической пары, называют электрохимической коррозией.Электрохимическая коррозия – разрушение металла в электролите свозникновением гальванической пары.ионы выходят в раствор, электроны перемещаются к менееактивному металлу, например к меди.разряжаются на менее активном металле, например на меди. Одним из наиболее широко распространенных видов электрохимическойкоррозии является ржавление обычной стали в водной среде и на воздухе. Наповерхности металлических изделий всегда имеется пленка влаги,адсорбированной из воздуха. Она является электролитом, так как в нейрастворены различные газы (СО2, SO2 и др.). Зерна карбида железа Fe3Схимически менее активны, чем железо. Поэтому возникают микрогальваническисэлементы: зерна Fe3С играют роль катодов, а зерна чистого железа — рольанодов. Железо разрушается — оно ржавеет. Протекающие при этом процессывесьма сложные. Укажем лишь суммарное уравнение реакции: Ржавчина имеет неопределенный состав [pic] Для защиты от коррозии металлов широко используют лакокрасочныепокрытия. Однако краски не вечны, изделия приходится перекрашивать. На этозатрачивается ручной труд, расходуется много лакокрасочных материалов. Из неметаллических покрытий для защиты стали и чугуна большое значениеимеет эмаль. Эмаль — это силикатное стекло с добавками оксидов металлов. Еенаносят на поверхность материала в виде порошка и обжигают при 500—1000 °С. Покрытия из эмалей обладают стойкостью по отношению к щелочам икислотам, длительно противостоят атмосферной коррозии. Но эмаль легкоразрушается при ударе. Благодаря термостойкости, декоративному виду,легкости очистки эмаль широко используется для покрытия изделий домашнегохозяйства и санитарной техники. С целью защиты металлов от коррозии (и для декоративных целей) издавнаиспользуют металлические покрытия. Железо оцинковывают, лудят (покрываютоловом), покрывают никелем, хромируют и т. д. Защитить металл от коррозии можно с помощью металла и другим способом.Например, если соединить железное изделие или сооружение проводником скуском более активного металла, например магния, то возникаетгальванический элемент. При этом сооружение (железо) играет роль катода, аболее активный металл выполняет роль анода. Анод разрушается, а катод —защищаемый металл — не изменяется. Такая защита называется протекторной. Одним из способов борьбы с коррозией является использованиеингибиторов. Это химические соединения, ничтожные концентрации которыхспособны почти полностью предотвращать коррозию. В некоторых случаях применение ингибиторов позволяет изготовлять аппаратуру из обычной стали вместо нержавеющей. Одно из наиболее эффективных направлений борьбы с коррозией металлов — создание коррозионно-стойких сплавов. В больших количествах выплавляют так называемые нержавеющие стали. В их состав входят металлы (хром, никель), образующие устойчивые защитные оксидные пленки. Билет №20.1 Окислительно-восстановительные реакции (разобрать на примерахвзаимодействия алюминия с оксидом железа (III), азотной кислоты с медью). К окислительно-восстановительным реакциям могут быть отнесеныхимические реакции следующих типов. Реакции замещения (вытеснения) Примером реакций этого типа может служить реакция между оксидом железа(III) и алюминием. В этой реакции алюминий вытесняет железо из раствора,причем сам алюминий окисляется, а железо восстанавливается. Приведем еще два примера: В этой реакции хлор вытесняет бром из раствора (хлор окисляется, бромвосстанавливается), содержащего ионы брома. Реакции металла с кислотами Эти реакции, в сущности, тоже представляют собой реакции замещения. Вкачестве примера приведем реакцию между медью и азотной кислотой. Медьвытесняет водород из кислоты. При этом происходит окисление меди, котораяпревращается в гидратированный катион, а содержащиеся в растворе кислотыгидратированные протоны азота восстанавливаются, образуя оксид азота. Реакции металлов с водой Эти реакции тоже принадлежат к типу реакций замещения. Онисопровождаются вытеснением из воды водорода в газообразном состоянии. Вкачестве примера приведем реакцию между металлическим натрием и водой: Реакции металлов с неметаллами Эти реакции могут быть отнесены к реакциям синтеза. В качестве примераприведем образование хлорида натрия в результате сгорания натрия ватмосфере хлора
Билет №21.1 Железо, положение в периодической системе, строение атома, возможныестепени окисления, физические свойства, взаимодействие с кислородом,галогенами, растворами кислот и солей. Сплавы железа. Роль железа всовременной технике. Железо находится в побочной подгруппе VIII группы периодическойсистемы. Электронная формула атома железа: Типичные степени окисления железа +2 и +3. Степень окисления +2проявляется за счет потери двух 4s-электронов. Степень окисления +3соответствует также при потере еще одного Зd-электрона, при этом Зd-уровеньоказывается заполненным наполовину; такие электронные конфигурацииотносительно устойчивы. Физические свойства. Железо – типичный металл, образует металлическуюкристаллическую решетку. Железо проводит электрический ток, довольнотугоплавко, температура плавления 1539°С. От большинства других металловжелезо отличается способностью намагничиваться. Химические свойства. Железо реагирует со многими неметаллами: Образуется железная окалина – смешанный оксид железа. Его формулузаписывают также так: FeО•Fe2О3. Реагирует с кислотами с выделением водорода: Вступает в реакции замещения с солями металлов, расположенных правеежелеза в ряду напряжений: Соединения железа. FeО — основной оксид, реагирует с растворами кислотс образованием солей железа (II). Fe2О3 — амфотерный оксид, реагирует такжес рас творами щелочей. Гидроксиды железа. Fe(ОН)2 — типичный основной оксид, Fe(ОН)3 обладаетамфотерными свойствами, реагирует не только с кислотами, но и сконцентрированными растворами щелочей. Гидроксид железа (II) легко окисляется до гидроксида железа (III)кислородом воздуха: При реакции солей железа (II) и (III) со щелочами в осадок выпадаютнерастворимые гидроксиды: Сплавы железа. Современная металлургическая промышленность производитжелезные сплавы разнообразного состава. Все железные сплавы разделяются по составу и свойствам на две группы.К первой группе относятся различные сорта чугуна, ко второй — различныесорта стали. Чугун хрупок; стали же пластичны, их можно ковать, прокаты^ вать,волочить, штамповать. Различие в механических свойствах чугунов и сталейзависит прежде всего от содержания в них углерода — в чугунах содержитсяоколо 4% углерода, а в сталях — обычно менее 1,4%. В современной металлургии из железных руд получают сначала чугун, азатем из чугуна — сталь. Чугун выплавляют в доменных печах, сталь варят всталеплавильных печах. До 90% всего выплавленного чугуна перерабатывают встали. Чугун. Чугун, предназначенный для переработки в сталь, называютпередельным чугуном. Он содержит от 3,9 до 4,3% С, 0,3—1,5% Si, 1,5—3,5%Мn, не более 0,3% Р и не более 0,07% S. Чугун, предназначенный'дляполучения отливок, называется литейным чугуном, В доменных печахвыплавляются также ферросплавы, применяемые преимущественно в производствесталей в качестве добавок. Ферросплавы имеют, по сравнению с передельнымчугуном, повышенное содержание кремния (ферросилиций), марганца(ферромарганец), хрома (феррохром) и других элементов. Стали. Все стали делятся на углеродистые и легированные. Углеродистые стали содержат в несколько раз меньше углерода, кремния имарганца, чем чугун, а фосфора и серы совсем мало. Свойства углеродистойстали зависят прежде всего от содержания в ней углерода: чем больше в сталиуглерода, тем она твёрже. Промышленность производит мягкие стали, сталисредней твёрдости и твёрдые. Мягкие стали и стали средней твёрдостиприменяются для изготовления деталей машин, труб, болтов, гвоздей и т. д.,а твёрдые стали—для изготовления инструментов. В сталях должно быть возможно меньше серы и фосфора, так как этипримеси ухудшают механические свойства сталей. В повышенных количествахсера вызывает красноломкость — образование трещин при горячей механическойобработке металла. Фосфор вызывает хладноломкость—хрупкость стали приобыкновенной температуре. - Легированные стали. Физические, химические и механические свойствасталей существенно изменяются от введения в их состав повышенногоколичества марганца и кремния, а также хрома, никеля, вольфрама и другихэлементов. Эти элементы называются легирующими, а стали — легированными [отлатинского слова ligare – связывать, соединять]. Наиболее широко в качестве легирующего элемента применяется хром.Особенно большое значение для сооружения машин, аппаратов и многих деталеймашин имеют хромоникелевые стали. Эти стали обладают высокой пластичностью,прочностью, жаростойкостью и стойкостью к действию окислителей. Азотнаякислота любой концентрации не разрушает их даже при температурах кипения.Хромоникелевые стали не ржавеют в атмосферных условиях и в воде. Блестящие,серебристого цвета, листы хромоникелевой стали украшают арки станции«Маяковская» Московского метро. Из этой же стали делают нержавеющие ножи,ложки, вилки и другие предметы домашнего обихода. Молибден и ванадий повышают твёрдость и прочность сталей приповышенных температурах и давлениях. Так, хромомолибденовые ихромованадиевые стали применяются для изготовления трубопроводов и деталейкомпрессоров в производстве синтетического аммиака, авиационных моторов. При резании с большой скоростью инструмент сильно разогревается ибыстро изнашивается. При добавлении вольфрама твёрдость стали сохраняется ипри повышенных температурах. Поэтому хромовольфрамовые стали применяютсядля изготовления режущих инструментов, работающих при больших скоростях' Увеличение содержания в стали марганца повышает её сопротивлениетрению и удару. Марганцовистые стали применяются для изготовленияжелезнодорожных скатов, стрелок, крестовин, камнедробильных машин. Применение легированных сталей позволяет значительно снизить весметаллических конструкций, повысить их прочность, долговечность инадёжность в эксплуатации. Билет №22.1 Неорганические вещества в полиграфии
Билет №24.1 Высшие кислородсодержащие кислоты химических элементов третьего периода, их состав и сравнительная характеристика свойств.
Фосфор образует целый ряд кислородсодержащих кислот (оксокислот). Некоторые
из них мономеры. например фосфиновая, фосфористая и фосфорная(V)
(ортофосфорная) кислоты. Кислоты фосфора могут быть одноосновными
(однопротонными) либо многоосновными (многопротонными). Кроме того, фосфор
образует еще полимерные оксокислоты. Такие кислоты могут иметь ациклическое
либо циклическое строение. Например, дифосфорная(V) (пирофосфорная) кислота
представляет собой димерную оксокислоту фосфора.
Наиболее важной из всех этих кислот является фосфорная(V) кислота (другое ее
название - ортофосфорная кислота). При нормальных условиях она представляет
собой белое кристаллическое вещество, расплывающееся при поглощении влаги из
воздуха. Ее 85%-ный водный раствор называют «сиропообразной фосфорной
кислотой». Фосфорная(V) кислота является слабой трехосновной кислотой:
H3PO4(водн)+H2O(ж)=H3O (+) (водн) +H2PO4 (-) (водн), pK1=2,12
H2PO4 (-) (водн) +H2O(ж) = H3O (+)(водн) +HPO4 (-)(водн), pK2=7,21
HPO4(-) (водн)+H2O(ж) = H3O (+)(водн) + PO4(3-)(водн),pK3=12,67
Хлор образует несколько кислородсодержащих кислот. Чем выше степень окисления
хлора в этих кислотах, тем выше их термическая устойчивость и сила кислоты:
НОCl < НСlO2 < НСlO3 < НClO4
НClO3 и НClO4 – сильные кислоты, причем НСlO4 –
одна из самых сильных среди всех известных кислот. Остальные две кислоты лишь
частично диссоциируют в воде и существуют в водном растворе преимущественно в
молекулярной форме. Среди кислородсодержащих кислот хлора только НСlO4
удается выделить в свободном виде. Остальные кислоты существуют только в
растворе.
Окислительная способность кислородсодержащих кислот хлора уменьшается с
возрастанием его степени окисления:
НОCl >НСlO2 > НСlO3 >НClO4
НОСl и НClO2 – особенно хорошие окислители. Например, кислый раствор НОCl:
1) окисляет ионы железа (II) до ионов железа (III):
2Fe(2+)(водн) +H3O(+) (водн) + HOCl(водн) =2Fe(3+)(водн)+2H2O(ж) + Cl(-) (водн)
2) на солнечном свету разлагается с образованием кислорода:
2OCl(-) (водн) = 2Cl(-)(водн) + O2(г)
3) при нагревании приблизительно до 75 °С он диспропорционирует на хлорид-
ионы и хлорат (V)-ионы:
3OCl(-) (водн) = 2Cl(-)(водн) + ClO3(-) (водн)
Остальные высшие кислотосодержащие кислоты эле