Водород.
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью.

| Получение: 1.В промышленности: Конверсионный способ. Вначале получают водяной газ, пропуская пары воды через раскаленный кокс при 1000 °С: С + Н2О -tà СО + Н2. Затем оксид углерода (II) окисляют в оксид углерода (IV), пропуская смесь водяного газа с избытком паров воды над нагретым до 400–450 °С катализатором Fe2O3: CO +H2O = CO2 + H2. Окисление метана водяным паром: CH4 + 2Н2O –(t, Ni)à4Н2 + CO2 Термическое разложение метана при 1200 °С: CH4 -tà C + 2H2 Электролиз водного раствора поваренной соли или гидроксида натрия: (NaOH) + 2Н2O –эл.токà 2Н2 + O2 2NaCl + 2H2O –эл.токà H2 + Cl2 + 2NaOH; 2. В лаборатории: Zn + 2HCl à ZnCl2 + Н2 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2; Si + 2NaOH + H2O = Na2SiO3 + 2H2. | Свойства: 1.С металлами: Н2 + 2Na -tà2NaH Н2 + Са -tà СаН2 2. С неметаллами: 2Н2 + O2 à 2Н2O Н2 + Cl2 -hvà 2HCl 3Н2 + N2 -t, p, кат.à 2NH3 H2 + S à H2S 3. С оксидами металлов (неактивных) и неметаллов: CuO + H2 à Cu + H2O 2NO + 2H2 = N2 + 2H2O. |
Водородные соединения металлов и неметаллов.
1. Ионные гидриды: Получение: Н2 + 2Na -tà2NaH
Свойства: разлагаются водой и кислотами:
NaH + Н2O à NaOH + Н2
СаН2 + 2HCl à CaCl2 + 2Н2
2. Ковалентные водородные соединения:
Все газы, кроме воды (водородные связи).
| CH4- метан | NH3-аммиак | H2O - вода | HF –фтороводород |
| SiH4 - силан | PH3 - фосфин | H2S - сероводород | HCl - хлороводород |
Неустойчивые: фосфин и силан.
Основными свойствами обладает: аммиак.
Амфотерные свойства проявляет: вода.
Кислоты образуют в водном растворе: сероводород и галогеноводороды.
Вода.
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличии от ее газообразных аналогов H2S, H2Se и Н2Те.
Свойства:
1. С металлами:
а) щелочные и щелочноземельные (кроме бериллия и магния): 2Na + 2Н2O = 2NaOH + Н2
б) остальные металлы в ряду активности до Н могут окисляться водяным паром до оксида при высокой температуре: Fe + 4Н2O-tà Fe3O4 + 4Н2
2. С оксидами щелочных и щелочноземельных металлов: Н2O + СаО = Са(OH)2
3. С кислотными оксидами растворимых кислот: P2O5 + 3H2O = 2H3PO4.
4. Гидролиз солей, бинарных соединений металлов и неметаллов:
2CuSO4 + 2Н2O ⇄ (CuOH)2SO4 + H2SO4
Al2S3 + 6H2O à 2Al(OH)3 + 3H2S
Са3Р2 + 6Н2О à 3Са(ОН)2 + 2РН3↑
PCl5 + 4H2O à H3PO4 + 5HCl
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварки металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- для получения аммиака и искусственного жидкого топлива, для гидрогенизации жиров.
Элементы IVA-группы.
| С | неметаллы |  Радиус атома растёт
Радиус атома растёт
|  Электроотри-цательность уменьшается Электроотри-цательность уменьшается
|  Металличес-кие свойства усиливаются Металличес-кие свойства усиливаются
| Степени окисления: + 4, +2, - 4(для неметаллов) |
| Si | |||||
| Ge | металлы | ||||
| Sn | |||||
| Pb |

Углерод.
1. Простое вещество. Имеет несколько аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Алмаз – кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло. Каждый атом углерода находится в состоянии sp3-гибридизации.
Алмаз. 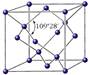
Графит – мягкое вещество серого цвета со слабым металлическим блеском, жирное на ощупь, проводит электрический ток. Атомы углерода находятся в состоянии sp2-гибридизации и связаны в плоские слои, состоящие из соединенных ребрами шестиугольников, наподобие пчелиных сот.
Графит. 
Графит – наиболее устойчивая при комнатной температуре аллотропная модификация углерода.
Карбин – мелкокристаллический порошок серого цвета, полупроводник. Его кристаллы состоят из линейных цепочек углеродных атомов, соединенных чередующимися тройными и одинарными связями, или двойными связями, углерод находится в состоянии sp-гибридизации: -С≡С-С≡С-С≡С-С≡С-
По твердости карбин превосходит графит, но значительно уступает алмазу.
Фуллерен - искусственно полученная модификация углерода, состоящая из молекул C60, C70, …. C1020. Эти молекулы составлены из атомов углерода, объединенных в пяти и шести угольники с общими ребрами. Это черные вещества с металлическим блеском, обладающие свойствами полупроводников. При давлении порядка 2·105 атм и комнатной температуре фуллерен превращается в алмаз.
Свойства углерода:
| Взаимодействие с фтором: углерод обладает низкой реакционной способностью, из галогенов реагирует только с фтором. | С + 2F2 = CF4. |
| Взаимодействие с кислородом: | 2С + О2(недост) = 2СО (угарный газ), С + О2(изб) = СО2(углекислый газ). |
| Взаимодействие с другими неметаллами: не взаимодействует с азотом и фосфором. | С + 2S = CS2 C + 2H2 –t, Nià CH4 Ca + 2C = CaC2 ЗС + 4Al =Al4С3 |
| Взаимодействие с водой: при пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород: | C + H2O = CO + H2. |
| Восстановительные свойства: углерод способен восстанавливать многие металлы из их оксидов: | 2ZnO + C –tà 2Zn + CO 4С + Fe3O4 –tà 3Fe + 4CO |
| Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV): | C + 2H2SO4 = CO2 + 2SO2 + 2H2O; C + 4HNO3 = CO2 + 4NO2 + 2H2O. |
Карбиды - это соединения углерода с металлами.
| Ковалентные | Ионные, или солеобразующие | |
| SiC. Имеют прочные ковалентные связи в атомной решетке, поэтому очень стабильны и химически инертны. | Карбиды, при гидролизе которых образуется метан – «метаниды»: Al4C3, Be2C Al4С3+12HCl =4AlCl3+ 3CH4 | Карбиды, при гидролизе которых получается ацетилен – «ацетилениды»: Na2C2, Ag2C2, CaC2 СаС2+2Н2O=Са(OH)2+С2Н2 Ag2C2 + 2HCl = 2AgCl + C2H2 |
Оксиды углерода.
| CO | CO2 | |
| Характеристика | угарный газ – б\ц, б\з, ядовит | углекислый газ – б/ц, б/з |
| Молекула оксида углерода (II) имеет линейное строение. Между атомами углерода и кислорода образуется тройная связь. | Молекула СО2 линейная, тип гибридизации углерода – sp2 | |
| Тип оксида | несолеобразующий | кислотный |
| CO + NaOH = HCOONa (формиат натрия) 2СО + О2 = 2СО2 СО + Н2 = С + Н2О СО + Cl2 = COCl2 (фосген) CO + CuO = Сu + CO2 | С + СО2 = 2СО. 2Mg + CO2 = 2MgO + C. Типичный кислотный оксид. Na2O + CO2 = Na2CO3, 2NaOH + CO2 = Na2CO3 + H2O, NaOH + CO2 = NaHCO3. Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды: Ca(OH)2 + CO2 = CaCO3↓ + H2O. | |
| Получение | 1)Образуется в газогенераторах при пропускании воздуха через раскаленный уголь: C + O2 = CO2, CO2 + C = 2CO. 2)Получается при термическом разложении муравьиной или щавелевой кислоты в присутствии концентрированной серной кислоты: HCOOH = H2O + CO, H2C2O4 = CO + CO2 + H2O | Получают углекислый газ обжигом известняка: CaCO3 = CaO + CO2, или действием сильных кислот на карбонаты и гидрокарбонаты: CaCO3 +2HCl =CaCl2 +H2O + CO2, NaHCO3 + HCl =NaCl +H2O +CO2. |

УГОЛЬНАЯ КИСЛОТА Н2СО3
При растворении углекислого газа в воде образуется очень слабая угольная кислота Н2СО3.
Углекислый газ в воде находится преимущественно в виде гидратированных молекул СО2 и лишь в незначительной степени в форме угольной кислоты. При этом в растворе устанавливается равновесие:
СО2(г) + Н2О ⇄ СО2 · Н2О (раствор) ⇄ Н2СО3 ⇄ Н+ + HCO3-
Угольная кислота – слабая неустойчивая кислота, которую в свободном состоянии из водных растворов выделить нельзя.

Карбонаты.
1) Карбонаты металлов (кроме щелочных) при нагревании разлагаются:
CuCO3 – tà CuO + CO2
2) При пропускании углекислого газа из карбонатов образуются гидрокарбонаты:
СаСО3 + СО2 + Н2О = Са(НСО3)2.
3) Гидрокарбонаты разлагаются до карбонатов: 2NaHCO3 – tà Na2CO3 + H2O + CO2.
4) Карбонаты и гидрокарбонаты вступают в обменные реакции:
а) с сильными кислотами (качественная реакция на карбонаты):
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑;
б) с растворимыми солями и основаниями, если образуется осадок:
Na2CO3 + Ва(ОН)2 = ВаСО3 ↓+ 2NaOH
Na2CO3 + СаСl2 = СаСО3 ↓+ 2NaCl
5) Гидрокарбонаты реагируют со щелочами, образуя средние соли:
КНСО3 + КОН = К2СО3 + Н2О
Кремний.
| Расположен в IV группе Периодической системы. На внешнем слое 4 электрона, которые имеют электронную конфигурацию 3s23p2. Проявляет степени окисления -4, +2, +4. | Второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Важнейшее соединение кремния — оксид SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем. SiO2 необходим для жизни растений и животных. Он придает прочность стеблям растений и защитным покровам животных. Благодаря ему тростники, камыши и хвощи стоят крепко, как штыки, острые листья осоки режут, как ножи, стерня на скошенном поле колет, как иголки, а стебли злаков настолько крепки, что не позволяют ниве на полях ложиться от дождя и ветра. Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как содержат кремнезем. |
Физические свойства. Вещество темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см3. Полупроводник. В отличие от металлов с повышением температуры его электропроводность увеличивается. На спутниках, космических кораблях и станциях устанавливают солнечные батареи, преобразующие солнечную энергию в электрическую. В них работают кристаллы полупроводников, и в первую очередь кремния.
Кремниевые фотоэлементы могут превратить в электрическую до 10% поглощенной солнечной энергии.
Химические свойства:
Кремний – типичный неметалл, может быть окислителем и восстановителем.
| Взаимодействие с галогенами: непосредственно взаимодействует только с фтором. С хлором реагирует при нагревании. | Si + 2F2 = SiF4 Si + 2Cl2 -tà SiCl4 |
| Взаимодействие с кислородом | Si + O2 -tàSiO2 |
| Взаимодействие с другими неметаллами: С водородом не взаимодействует. | Si + C -tàSiC 3Si + 2N2 = Si3N4 |
| Взаимодействие с галогеноводородами. С фтороводородом реагирует при обычных условиях, с хлороводородом – при 300 °С, с бромоводородом – при 500 °С. | Si + 4HF = SiF4 + 2H2 |
| Взаимодействие с металлами: образует силициды. | 2Ca + Si = Ca2Si силицид кальция Si + 2Mg = Мg2 Si Силициды легко разлагаются водой или кислотами, при этом выделяется газообразное водородное соединение кремния — силан: Мg2 Si + 2Н2SO4 = 2MgSO4 + SiH4 В отличие от углеводородов силан на воздухе самовоспламеняется и сгорает с образованием диоксида кремния и воды: SiH4 + 202 = SiO2 + 2Н2О Повышенная реакционная способность силана по сравнению с метаном СН4 объясняется тем, что у кремния больше размер атома, чем у углерода, поэтому химические связи —Н слабее связей С—Н. |
| Взаимодействие с кислотами. Устойчив к действию кислот, взаимодействует только со смесью плавиковой и азотной кислот. | 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O |
| Растворяется в щелочах, образуя силикат и водород: | Si + 2NaOH + H2O = Na2SiO3 + H2 |
Получение кремния.
| В лаборатории: Восстановлением из оксида магнием или алюминием: SiO2 + 2Mg = Si + 2MgO; 3SiO2 + 4Al = 3Si + 2Al2O3. | В промышленности: 1)Восстановлением из оксида коксом в электрических печах: SiO2 + 2C -tà Si + 2CO. При таком процессе Si загрязнен карбидами кремния. 2) Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С: SiCl4 +2H2-tàSi + 4HCl, или цинком: SiCl4 + 2Zn -tà Si + 2ZnCl2. 3)Также чистый кремний получается при разложении силана: SiH4 -tà Si + 2H2 |
Силициды – соединения кремния с металлами, в которых кремний имеет степень окисления -4.
Силициды щелочных и щелочно-земельных металлов характеризуются ионным типом связи, они химически активны. Они легко разлагаются водой или разбавленными кислотами с выделением силана: Ca2Si + 2H2SO4 = 2CaSO4 + SiH4.
В силицидах неметаллов ковалентная связь. Среди таких силицидов наибольшее значение имеет карбид кремния – карборунд SiC, имеющий структуру алмаза, он характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах: 2Mg + Si = Mg2Si,
2MgO + SiO2 + 4C = Mg2Si + 4CO.
Силан SiH4. (моносилан).
| Образуются при действии на силицид магния соляной кислотой: Mg2Si + 4HCl = 2MgCl2 + SiH4. | SiH4 + 2O2 = SiO2 + 2Н2O (самовоспламенение на воздухе) Активно взаимодействует со щелочами: SiH4 + 2NaOH + H2O = Na2SiO3 + 4H2. При нагревании разлагается: SiH4 = Si + 2H2. |
Оксид кремния (IV) – кислотный оксид.
В природе – речной песок, кварц.
Не реагирует с водой – т.к. кремниевая кислота нерастворима.
2) При сплавлении реагирует со щелочами: SiO2 + 2KOH -tàK2SiO3 + H2O
3) Реагирует с основными оксидами: SiO2 + MgО -tàMgSiO3 и карбонатами щелочных металлов: SiO2 + K2CO3 -tà K2SiO3 + CO2 при сплавлении.
4) Из кислот растворяется только в плавиковой: SiO2 + 6HF = H2[SiF6] + 2H2O
5) При температуре выше 1000 °С реагирует с активными металлами, при этом образуется кремний: SiO2 + 2Mg = Si + 2MgO
или при избытке восстановителя – силициды: SiO2 + 4Mg = Mg2Si + 2MgO.
6) Взаимодействие с неметаллами.
Реагирует с водородом: SiO2 + 2Н2 = Si + 2Н2O,
Взаимодействует с углеродом: SiO2 + 3С = SiС + 2СO.
Кремниевая кислота.
Имеет полимерное строение и состав xSiO2 • yH2O. В водных растворах доказано существование ортокремниевой H4SiO4, метакремниевой H2SiO3 кислот.
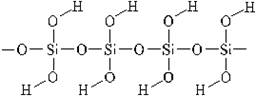
Получение: только косвенным путём, из солей: Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
Na2SiO3 + 2Н2O + 2CO2 = 2NaHCO3 + H2SiO3↓,
Свойства: 1)Растворяются в концентрированных щелочах: H4SiO4 +4KOH à K4SiO4 + 4H2O
2)Разлагаются при нагревании: H2SiO3 -tàSiO2 + H2O
Силикаты.
Большинство нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом». Их водные растворы — это хорошо известный силикатный клей.
Получение: 1) растворение кремния, кремниевой кислоты или оксида в щелочи:
H4SiO4 + 4KOH à K4SiO4 + 4H2O
Si + 2NaOH + H2O = Na2SiO3 + H2
SiO2 + 2KOH -tàK2SiO3 + H2O
2) Сплавление оксидов: СаО + SiO2 -tà CaSiO3
3) Сплавлением диоксида кремния с карбонатами: SiO2 + СаС03 = СаSiO3 + С02
4) Взаимодействие солей: K2SiO3 + CaCl2 = CaSiO3 + 2KCl
Из растворов силикатов действием на них более сильных кислот — соляной, серной, уксусной и даже угольной получается кремниевая кислота Н2SiO3:
К2SiO3 + 2НСl = 2КСl + Н2SiO3
Следовательно, Н2SiO3 очень слабая кислота. Она нерастворима в воде и выпадает из реакционной смеси в виде студенистого осадка, иногда заполняющего компактно весь объем раствора, превращая его в полутвердую массу, похожую на студень, желе. При высыхании этой массы образуется высокопористое вещество — силикагелъ, широко применяемый в качестве адсорбента — поглотителя других веществ.