Чтобы проинтегрировать какое-либо термодинамическое выражение функции, например:  ;
;  , нужно знать уравнение состояния тела.
, нужно знать уравнение состояния тела.
Для идеальных газов: PV=RT 
 , тогда
, тогда  дает
дает  .
.
Для чистого реального газа, состояние которого описывается уравнением Бертло:

Интегрируем и получаем:
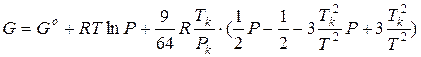
(при интегрировании принято Po = Pстанд = 1 атм).
Расчеты по таким уравнениям трудны и их точность ограничена точностью входящих в них эмпирических констант.
По этой причине вместо давления вводят величину, называемую фугитивностью или летучестью f. Фугитивность имеет размерность давления (Па, атм) и связана с давлением реального газа следующим соотношением:
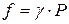
где γ – безразмерный коэффициент фугитивности,зависящий от давления и температуры  .
.
Фугитивность – это такое давление реального газа, при котором газ ведет себя как идеальный.
При f→P свойства реальных газов приближаются к свойствам идеальных газов, а коэффициент фугитивности стремится к единице γ→1.
В реальной газовой смеси парциальная фугитивность i -го компонента равна:

где Рi – парциальное давление i -го компонента в смеси газов.
Применение фугитивности вместо парциальных давлений практикуется при относительно высоких давлениях и низких температурах, когда наблюдаются значительные отклонения от идеальности.
Для 1 моль чистого газа:
 (1)
(1)
Для 1 моль i -го газа в смеси:
 (2)
(2)
где µ i 0 – стандартный химический потенциал i -го компонента при Р=1 атм, Т=298 К и γ=1.
На основании данных по фугитивности при помощи уравнения (2) можно определить константу равновесия для реального газа.
Для реакции:
аА+вВ=сС+dD

K f – термодинамическая константа равновесия (безразмерная величина).
Уравнение изобары Вант-Гоффа:

K f ≠ f (P); Kp=K f только при малых давлениях, когда реальная газовая смесь приближается к идеальному состоянию.
Тесно связана с фугитивностью и величина активности:

где с – концентрация газа или реального раствора.
Величина активности используется не только применительно к реальным газам, но и к реальным растворам.
γ – безразмерный коэффициент активности, зависит от с и Т, т.е. γ = f (с,Т).
Активность – это такая концентрация, при использовании которой реальные растворы приобретают термодинамические свойства идеальных растворов. Активность имеет размерность концентрации.
Химический потенциал i -го компонента в растворе можно выразить:

где µ i 0 – стандартный химический потенциал, когда активность i -го компонента равна единице ai = 1.
Для химических реакций в реальных растворах константу равновесия можно выразить следующим образом:
 или
или
 , где
, где
γ – коэффициенты активности для исходных веществ и продуктов реакции.
Таким образом, равновесие химической реакции в зависимости от условий, можно выразить константами равновесия: Kp, Kc, KN, K f и K a.
Несмотря на различия констант в различных типах химических реакций, суть у них одна: количественное определение условий равновесия в обратимых процессах.
РАСЧЕТ ФУГИТИВНОСТИ.
Существует 2 метода расчета:
1.  дифференцируем по давлению при Т=const.
дифференцируем по давлению при Т=const.
 ;
; 


 или RTdln f = VdP (3), где
или RTdln f = VdP (3), где
V – мольный объем реального газа при температуре Т и давлении Р.
Величина (RT/P)ид. для идеального газа отличается от величины (RT/P)реальн.=V для реального газа на величину α:

Подставляем это значение в уравнение (3):
 ;
;  .
.
Интегрируем это выражение от Р=0 до Р при Т=const:
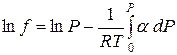
α – находят экспериментально по измерению мольных объемов газа.
2. Для решения технических задач:
 (4), где
(4), где
Pид – гипотетическое давление идеального газа, занимающего объем V одного моля реального газа, т.е. 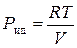 . Объем V при давлении Р и температуре Т должен быть известен. Соотношение (4) дает достаточно точные значения фугитивности в области умеренных давлений.
. Объем V при давлении Р и температуре Т должен быть известен. Соотношение (4) дает достаточно точные значения фугитивности в области умеренных давлений.