Введение в курс химии
Химия в энергетическом институте – фундаментальная общетеоретическая дисциплина.
Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
М.В.Ломоносов (1741 г.) – “Химическая наука рассматривает свойства и изменения тел…, состав тел…,объясняет причину того, что с телами при химических превращениях происходит”.
Д.И.Менделеев (в “Основах химии” 1871 г.) – “Химия – это учение об элементах и их соединениях”.
Понимание законов химии и их применение позволяет создавать новые процессы, машины, установки и приборы. Получение электроэнергии, топлива, металлов, различных материалов, продуктов питания и т.п. непосредственно связано с химическими реакциями. Например, электрическую и механическую энергии в настоящее время в основном получают преобразованием химической энергии природного топлива (реакции горения, взаимодействия воды и ее примесей с металлами и т.п.). Без понимания этих процессов невозможно обеспечить эффективную работу электростанций и двигателей внутреннего сгорания.
Тема 1. Электронное строение атома.
Атом - сложная электромагнитная микросистема, являющаяся носителем свойств химического элемента.
 протоны (р, р+)
протоны (р, р+)
 ядро
ядро

 атом нейтроны (n, no) 1840
атом нейтроны (n, no) 1840
электроны (е-)
 массовое число
массовое число
35Cl (17p+, 18n, 17e-)
 заряд ядра 17
заряд ядра 17
Мr(Cl)=35*0,7543 + 37*0,2457 = 35,491
Квантовая механика - поведение движущихся микрообъектов (в том числе и электронов) – это одновременное проявление как свойств частиц так и свойств волн.
Частица – m, m v, E1 =m v 2
Волна - l, n, E2 = hn = h v /l
Луи де Бройль (1924г.): Е1 = Е2; l=h/ m v
h – постоянная Планка, 6,626×10-34Дж×с
Принцип неопределенности - Вернер Гейзенберг (1927г.)
|
Точное нахождение частицы (электрона) заменяется понятием статистической вероятностью нахождения ее в определенном объеме (около ядерного) пространства.
Движение е- - волновой характер – волновая функция
y =y(х,у,z).
ê y ê2dv - плотность вероятности нахождения е- в определенном объеме около ядерного пространства. Это пространство называется атомной орбиталью(АО).
Квантовые числа (n, l, ml) – характеристики АО.
1. Главное квантовое число (n):
· определяет – энергию электрона – энергетический уровень
· показывает – размер электронного облака (орбитали)
· принимает значения – от 1 до µ
n (энерг. ур.): 1 2 3 4 и т.д.
K L M N
 Ее увеличивается
Ее увеличивается
2. Орбитальное квантовое число (l):
· определяет – орбитальный момент количества движения электрона
· показывает – форму орбитали
· принимает значения – от 0 до (n -1)
 Графически любая АО изображается
Графически любая АО изображается
Орбитальное квантовое число: 0 1 2 3 4
 Энергетический подуровень: s p d f g
Энергетический подуровень: s p d f g
Еувелич.

 z
z

 l =0® s –подуровень ® s –АО ® x
l =0® s –подуровень ® s –АО ® x
y



 l =1 ® p- подуровень ® р -АО ® х
l =1 ® p- подуровень ® р -АО ® х
y
Каждому n соответствует определенное число значений l, т.е. каждый энергетический уровень расщепляется на подуровни. Число подуровней равно номеру уровня.
1-ый энерг.уровень ® 1 подуровень ® 1 s
2-ой энерг.уровень ® 2 подуровня ® 2s2p
3-ий энерг.уровень ® 3 подуровня ® 3 s 3 p 3 d
4-ый энерг.уровень ® 4 подуровня ® 4 s 4 p 4 d 4 f и т.д.
3. Магнитное квантовое число (ml)
· определяет – значение проекции орбитального момента количества движения электрона на произвольно выделенную ось
· показывает – пространственную ориентацию АО
· принимает значения – от – l до + l
 Любому значению l соответствует (2 l +1) значений магнитного квантового числа, т.е. (2 l +1) возможных расположений электронного облака данного типа в пространстве.
Любому значению l соответствует (2 l +1) значений магнитного квантового числа, т.е. (2 l +1) возможных расположений электронного облака данного типа в пространстве.
s -состояние – одна орбиталь (2×0+1=1) - ml= 0, т.к. l =0
 p -состояние – три орбитали (2×1+1=3)
p -состояние – три орбитали (2×1+1=3)
ml: +1 0 -1, т.к. l =1
 z ml= 1 z ml =0 z ml = -1
z ml= 1 z ml =0 z ml = -1
Все орбитали, принадлежащие одному подуровню, имеют одинаковую энергию и называются вырожденными.
Вывод – АО характеризуется определенным набором n,l,ml, т.е. определенными размерами, формой и ориентацией в пространстве.
4. Cпиновое квантовое число (ms)
- определяет - собственный механический момент электрона, связанный с вращением его вокруг своей оси
-
 принимает значения - +1/2 h/2p или –1/2 h/2p
принимает значения - +1/2 h/2p или –1/2 h/2p
В многоэлектронном атоме состояние электрона определяется принципом Паули:
|


 Следствия из принципа Паули:
Следствия из принципа Паули:
- на одной орбитали могут находиться не более двух электронов, отличающихся друг от друга спинами
- максимальное число электронов на энергетическом подуровне – 2(2 l +1)
- максимальное число электронов на энергетическом уровне – 2 n 2
Электроны в атоме (основное состояние) распределяются в соответствии с принципом минимальной энергии:
|
Правило Клечковского:
|
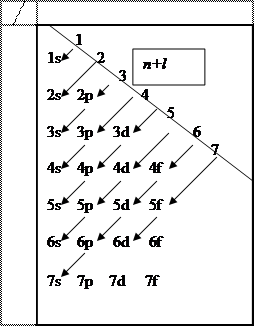
n l 0 1 2 3
|
 | |||
 | |||
Существует два способа составления схем распределения электронов в атоме:
- в виде формул электронных конфигураций
19 К 1s22s22 p 63 s 23 p 64 s 1
- в виде графических формул АО
 Е p
Е p
s
n = 2
8О
s
n = 1