Определение интегральной теплоты растворения проводится в калориметре простейшего типа (рисунок 1).
| Рис. 1. Общий вид калориметра: 1 – калориметрический стакан; 2 – магнитная мешалка; 3 – пластмассовая крышка; 4 – воронка; 5 – датчик температуры; 6 - нагреватель | 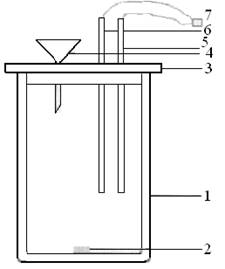
|
Взвесьте с точностью до сотых 2,5 г соли.
В калориметрический стакан налить 150 мл дистиллированной воды. Оставьте небольшое количество воды (~10 мл) в цилиндре.
Опустите в калориметрический стакан сердечник магнитной мешалки и включите в розетку блок питания.
Нажмите и удерживайте в течение 2 сек. кнопку «ВКЛ» на измерительном преобразователе «ЭКСПЕРТ-001-3»
Вращая ручку включения магнитной мешалки, добейтесь оптимальной скорости вращения сердечника магнитной мешалки.
Подтвердите время работы электрического нагревателя 200с при определении теплового значения калориметра. Для этого на клавиатуре измерительного преобразователя нажмите кнопку «Ф2» и «ВВОД».
Кнопками «стрелка влево» или «стрелка вправо» выберите режим «ТЕРМОМЕТР».
Начните выполнение опыта, нажав кнопку «ИЗМ». На дисплее появятся данные работы секундомера, работающего в режиме прямого отсчета времени и значения температуры.
Записывайте в рабочий журнал в таблицу 1 показания термометра через каждые 30 с. до стабилизации. Система считается стабилизированной,если в равные промежутки времени температура или меняется на одну и ту же малую величину, или остается неизменной.
В определенный момент времени, отметив его в рабочем журнале, высыпьте в калориметрический стакан через сухую воронку приготовленную навеску соли, оставшейся водой в цилиндре смойте остатки соли с воронки.
Таблица 1
Результаты экспериментальных данных
| Время измерений, с | ||||
| Температура измерений, 0С |
За счет растворения соли происходит быстрое изменение температуры, поэтому пока наблюдается рост температуры, фиксируйте значения через возможно малые промежутки времени (каждые 5-10с).
После того, как растворение соли закончится, изменение температуры замедлится и температурный хо станет равномерным, продолжайте измерения через каждые 30 с. до стабилизации.
Определите тепловое значение калориметрической установки. Для этого нажмите «Ф2». На дисплее появится время, установленное вначале эксперимента для нагрева калориметрической установки. Секундомер начнет работать в режиме обратного отсчета времени. Записывайте данные измерений температуры в рабочий журнал в таблицу 1 каждые 30 с до стабилизации.
После отключения тока нагревателя, рост температуры замедлится, а затем температуры начнет медленно падать, фиксируйте ее изменение через каждые 30 с до стабилизации.
Нажмите клавишу «ОТКЛ» на клавиатуре измерительного прибора.
Результаты температурных измерений представьте в виде графика. На оси абсцисс нанесите время в секундах, на оси ординат – показания температуры.
Тепловой эффект химической реакции может быть рассчитан по формуле:
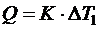 (5),
(5),
где К - тепловое значение калориметра, количество теплоты, которое необходимо для нагревания калориметра с его содержимым на 1 0С.
Тепловое значение калориметра определяется экспериментально. Для этого, с помощью электрического нагревателя, включенное в заданное время Dt, калориметрической системе сообщается точно известное количество теплоты q эл и измеряется соответствующее ему изменение температуры.
Количество тепловой энергии q эл, сообщенное калориметрической системе при нагреве, вычисляется по формуле Джоуля:
 (6),
(6),
где U - напряжение постоянного тока, подаваемого на нагреватель, В;
r – сопротивление нагревателя, Ом;
Dt - время нагрева калориметра, с.
Тепловое значение калориметра:
 (7).
(7).
Подставив значение К в формулу, получим значение теплового эффекта реакции.
Измеренный тепловой эффект следует отнести к 1 моль вещества, для чего необходимо разделить его на число молей (n) того из участников реакции, который находится в недостатке, тогда:
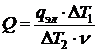 (8).
(8).
Оформление работы см. в разделе 2.7.
Контрольные вопросы
1. Тепловой эффект реакции. Соотношение между теплотами реакций при постоянном давлении и при постоянном объеме.
2. В чем заключается калориметрический метод измерения теплоты гидратации соли?
3. Физический смысл постоянной калориметра.
4. Теплота растворения. Почему процессы растворения веществ могут протекать не только с экзотермическим, но и с эндотермическим эффектом.
Лабораторная работа № 2