Цель работы.
Изучить один из классических способов опытного определения отношения изобарной теплоемкости к изохорной для двухатомного газа (для воздуха).
Указания по подготовке к работе.
При подготовке к работе необходимо:
ü проработать данное руководство;
ü познакомиться с отдельными параграфами рекомендуемых учебников;
ü уметь ответить на контрольные вопросы.
Основные теоретические положения.
Если нагревать тело, т. е. сообщать ему энергию в форме теплоты, то она пойдет на увеличение температуры тела и работу расширения, которую совершит тело против внешних сил. Это распределение энергии определяется первым началом (первым законом) термодинамики. Оно может быть сформулировано следующим образом:
Энергия, сообщенная системе в форме теплоты, идет на изменение ее внутренней энергии и на работу расширения, которую она выполняет против внешних сил.
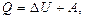 (1)
(1)
где:  - изменение внутренней энергии;
- изменение внутренней энергии;
A - работа расширения; Q - энергия в форме теплоты.
Внутренняя энергия – это кинетическая энергия движения частиц и потенциальная энергия их взаимодействия. Для идеального газа потенциальной энергией взаимодействия пренебрегают и рассматривают внутреннюю энергию как кинетическую энергию движения частиц. Внутренняя энергия является функцией состояния системы, её изменение не зависит от пути перехода системы из одного состояния в другое, а определяется только разностью конечного U1и начального U2 состояний.
Работу расширения газа при изменении его объёма можно рассчитать по формуле

| (2) |
Интегрирование выражения (3.2) определяется характером зависимости между давлением объемом газа, т.е. процессом.
Теплоемкостью тела называется количество теплоты, необходимое для нагревания тела на один градус.
Удельная теплоемкость – количество теплоты, необходимое для нагревания единицы массы вещества на один градус  .
.
Молярная теплоемкость – количество теплоты, необходимое для нагревания 1 моля вещества на один градус.
 (3)
(3)
где: т - масса вещества;
μ - молярная масса;
ΔT - разность температур.
Если нагревать вещество при постоянном объеме, то подводимая теплота идет только на увеличение внутренней энергии. В этом случае говорят о теплоёмкости при постоянном объёме или изохорной теплоёмкости CV. Если нагревать вещество при постоянном давлении, то подводимая теплота идет не только на увеличение внутренней энергии, но и на работу расширения. В этом случае говорят о теплоёмкости при постоянном давлении или изобарной теплоёмкости CP.
Для идеального газа между молярными изохорной и изобарной теплоёмкостями существует следующая связь (уравнение Майера): 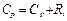 (4)
(4)
где: R - универсальная газовая постоянная.
Теплоёмкости газов при комнатных температурах можно рассчитывать по классической теории теплоёмкостей, созданной во второй половине прошлого века. В основу этой теории положен закон равномерного распределения кинетической энергии по степеням свободы. В нём говорится, что энергия между всеми видами движения частиц вещества распределяется равномерно. Иначе говорят, что на каждую степень свободы приходится одинаковая доля энергии, равная

где: k - постоянная Больцмана; T - температура;
Число степеней свободы механической системы – число независимых координат, полностью определяющих её положение и конфигурацию в пространстве. Если через і обозначить число степеней свободы молекулы, то средняя кинетическая энергия такой молекулы определится выражением

|
 Энергия одного моля такого газа определяется по формуле
Энергия одного моля такого газа определяется по формуле
где:  - постоянная Авогадро.
- постоянная Авогадро.
Тогда молярная теплоёмкость при постоянном объеме может быть рассчитана из выражения 

при постоянном давлении - 
Для одноатомных газов (He, Ar, Neи т.д.) i = 3, тогда



Для двухатомных газов (О2, Н2,СОи т. д.) і = 5, тогда 



Для многоатомных газов (молекула состоит из трех и более атомов: СО2, Н2О,NH3и т. д.) i =6,тогда




Адиабатический процесс – это процесс, происходящий без обмена энергией между системой и окружающей средой. В уравнении (1) Q = 0 и A = -ΔU. Это означает, что в адиабатическом процессе расширение газа происходит за счет запаса внутренней энергии и приводит к его уменьшению, а следовательно, и уменьшению температуры. Уравнение адиабатического процесса (уравнение Пуассона) имеет вид:
 (5)
(5)
где: γ - показатель адиабаты; Р - давление газа; V - объём газа.
4. Методика эксперимента.
В работе определяется отношение теплоёмкости при постоянном давлении к теплоёмкости при постоянном объёме воздуха.
 Установка (рис.1) для измерения отношения теплоёмкостей представляет собой стеклянный баллон (1), который может сообщаться с атмосферой через кран (2) и нагнетающий насос (3). Измерение избыточного по отношению к атмосфере давления в баллоне осуществляется водяным манометром (4).
Установка (рис.1) для измерения отношения теплоёмкостей представляет собой стеклянный баллон (1), который может сообщаться с атмосферой через кран (2) и нагнетающий насос (3). Измерение избыточного по отношению к атмосфере давления в баллоне осуществляется водяным манометром (4).
С помощью насоса (3) в баллоне (1) создают избыточное давление ΔР1; после установления равновесия (температура воздуха в баллоне становится равной температуре окружающей среды), краном (2) выпускают воздух из баллона до тех пор, пока давление в баллоне не станет равным атмосферному. Процесс этот осуществляется весьма быстро и может считаться адиабатическим. В свою очередь адиабатическое расширение приводит к охлаждению оставшегося газа в баллоне.
Когда давление в баллоне станет равным атмосферному, кран (2) тотчас закрывают и охладившийся воздух в баллоне начинает нагреваться изохорически (V = const) за счет теплообмена с окружающей средой через стенки баллона. При этом давление в баллоне, по сравнению с атмосферным, повышается. После выравнивания температуры в баллоне устанавливается избыточное давление ΔР2, которое измеряется манометром (4).
Для адиабатического расширения воздуха в баллоне можно записать  или
или  (6)
(6)
где: Р1 - давление в баллоне перед выпуском воздуха, оно равно

Ро - атмосферное давление;
ΔР1 - избыточное давление;
Р2 - давление после выпускания воздуха из баллона, оно равно атмосферному Р2 = Ро ;
Т1 - начальная температура воздуха в баллоне, она равна комнатной температуре Т1 = То;
Т2 - температура воздуха в баллоне после адиабатического расширения (ниже комнатной).
С учетом изложенного выше (6) запишется
 или
или  (7)
(7)
Для изохорического нагревания воздуха в баллоне можно записать
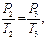
| (8) | |||
| где: | 
| - давление воздуха в баллоне после нагревания воздуха до комнатной температуры: 
| ||

| - избыточное давление; | |||

| - температура воздуха в баллоне после изохорического нагревания, она равна комнатной температуре  . .
| |||
С учётом этого, уравнение (8) запишется

| или | 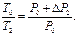
| (9) |
Подставив (9) в (7), получим

| (10) |
Логарифмируя выражение (10), имеем

|
| или |

|
В последнем выражении  и
и  , тогда данные величины
, тогда данные величины  и
и  весьма малы. Для малых значений х имеем
весьма малы. Для малых значений х имеем
 ; тогда
; тогда  , откуда
, откуда

| (11) |
Так как давление связано с высотой столба жидкости пропорционально: ΔР = ρgh, то можно перейти к соотношению
 (12)
(12)
где: Δh1 - разность уровней жидкости в манометре (4) после нагнетания воздуха в начале опыта;
Δh2 - разность уровней жидкости в манометре (4) после выпуска воздуха и установления равновесия в конце опыта.