Гравиметрический (весовой) анализ - совокупность методов количественного анализа, основанных на точном измерении массы вещества.
Сущность гравиметрического анализа:
· В гравиметрическом анализе используют прямое измерение массы при помощи взвешивания.
· Определяемую составную часть выделяют либо в чистом виде, либо в виде определенного соединения.
· Определение массы является не только начальной, но и конечной стадией анализа.
· Основным измерительным прибором являются аналитические весы.
В гравиметрическом анализе используют методы:
· Отгонки определяемого вещества в виде какого – либо летучего соединения. Этот метод используют, например, для определения содержания кристаллизационной воды в кристаллогидратах, а также при анализе карбонатов, некоторых нитратов и других соединений, образующих летучие продукты реакции. Содержание определяемого компонента находят по разнице массы вещества до и после термической обработки.
· Осаждения из раствора в виде малорастворимого соединения. В этом случае гравиметрический анализ проводят по массе осадка,
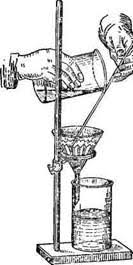 образовавшегося при взаимодействии определяемого компонента с раствором какого либо реагента (осадителя).
образовавшегося при взаимодействии определяемого компонента с раствором какого либо реагента (осадителя).
Гравиметрический анализ с использованием осаждения включает несколько операций:
1) отбор средней пробы анализируемого образца;
2) взвешивание навески для анализа;
3) растворение навески;
4) осаждение определяемого компонента в виде малорастворимого соединения, называемого осаждаемой формой;
5) отделение осадка фильтрованием;
6) промывание осадка;
7) высушивание осадка;
Рис. 1. Фильтрование
8) прокаливание осадка для превращения его в подходящую для взвешивания химическую форму, называемую гравиметрической. Прокаливание ведут на газовой горелке или в муфельной печи.
 Рис. 2. Муфельная печь
Рис. 2. Муфельная печь
9) взвешивание осадка (гравиметрической формы);
10) вычисление результатов анализа.
Результаты гравиметрических определений обычно выражают в процентах, реже – в единицах массы.
Титриметрический анализ (титриметрия) – метод количественного анализа, в котором содержание вещества определяется путем точного измерения объема раствора реагента (титранта), вступившего в химическую реакцию с определяемым веществом. Концентрация раствора титранта должна быть точно известна.
Титрование – непрерывно контролируемый процесс постепенного, небольшими порциями добавления одного вещества (титранта) к другому. Момент, когда титрант добавили в исследуемый раствор в количестве, химически эквивалентном определяемому веществу, называют точкой эквивалентности. Для определения этого момента в исследуемый раствор добавляют индикатор. Окраска индикатора изменяется, когда реакция между определяемым веществом и титрантом доходит до конца. Практически изменение цвета не точно совпадает с точкой эквивалентности. В этом случае говорят о точке конца титрования (к.т.т.). Т.е. это такой момент титрования, когда по изменению окраски раствора индикатора или по другим признакам замечают конец реакции.
По затраченному объему титранта и его концентрации вычисляют результаты анализа.
 Независимо от типа используемой реакции для любого титриметрического определения необходимо иметь:
Независимо от типа используемой реакции для любого титриметрического определения необходимо иметь:
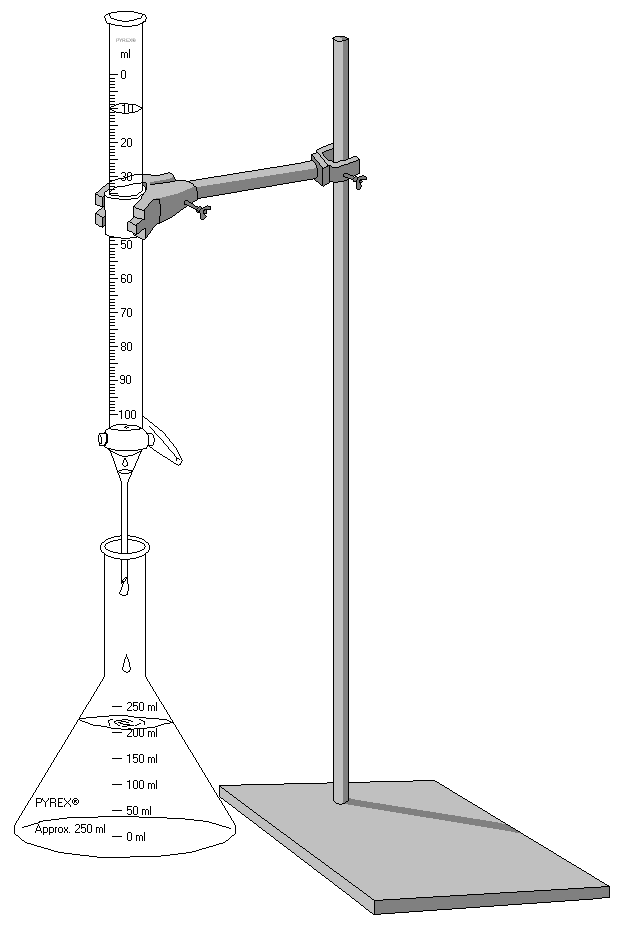
1) измерительную посуду для точного установления объемов реагирующих веществ (бюретки, пипетки и мерные колбы). Титрование производят с помощью бюретки, заполненной тит-
рантом;
2) индикатор – вещество, способное изменять цвет растворов при титровании (иногда раствор титранта одновременно является индикатором);
3) титрант - рабочий титрованный раствор с точно известной концентрацией реагента.
Рис. 3. Титрование: в бюретке титрант, в
колбе — проба определяемого вещества
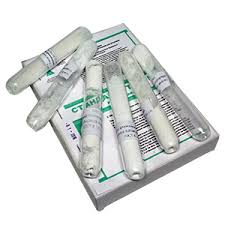
Широкое применение имеют титрованные растворы, приготовленные из фиксаналов или стандарт-титров. Фиксанал представляет собой запаянную стеклянную трубку с количеством вещества, необходимым для приготовления 1 л точно 0,1 н. или 0,01 н. раствора.
Выпускают фиксаналы серной и хлороводородной кислот, гидроксидов калия и натрия, оксалата натрия, карбоната натрия, перманганата калия и др.
В зависимости от типа химических реакций в титриметрическом анализе выделяют:
· методы кислотно-основного титрования или методы нейтрализации, основанные на реакции между кислотным и щелочным реагентами;
HCl (водн.) + NaOH (водн.) = NaCl (водн.) + H2O (ж.)
· методы окисления-восстановления, основанные на взаимодействии между окислителем и восстановителем (например, йодометрия, перманганатометрия);
J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
· методы комплексообразования, основанные на образовании малодиссоциирующих комплексных ионов или молекул;
· методы осаждения, основанные на реакциях образования малорастворимых соединений (например, аргентометрия, меркуриметрия).
NaCl + AgNO3 → AgCl ↓ + NaNO3
Вопросы:
1. На чем основан гравиметрический анализ?
2. Какие формы осадка называются осаждаемой и гравиметрической?
3. Перечислите основные этапы гравиметрического анализа с использованием осаждения.
4. На чем основан титриметрический анализ?
5. Дайте определение терминов: «титрование», «титрант», «индикатор», «точка эквивалентности», «конечная точка титрования».
6. Что такое фиксанал?