ВЕЩЕСТВА КЛЕТКИ.

 Неорганические соединения клетки – вода и неорганические ионы.
Неорганические соединения клетки – вода и неорганические ионы.
Вода – важнейшее неорганическое вещество клетки.
Все биохимические реакции происходят в водных растворах.
По отношению к воде все вещества клетки
делятся на:
v гидрофильные (хорошо растворимые в воде) – сахара, многие минеральные соли, аминокислоты, водорастворимые витамины (вит.С, вит.гр. В) и др.;
v гидрофобные (нерастворимые в воде) – липиды (жиры, масла, воск, стероиды и др.),
полисахариды, ДНК, РНК, многие белки, жирорастворимые витамины (А,Д,Е,К)
Особенности строения, свойства воды:
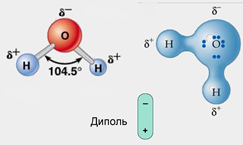
1.Молекулы воды полярны–являются диполями
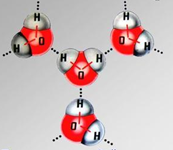
 2.Способность образовывать водородные между молекулами воды.
2.Способность образовывать водородные между молекулами воды.
 3.Не сжимаемость.
4. Химическая активность
3.Не сжимаемость.
4. Химическая активность
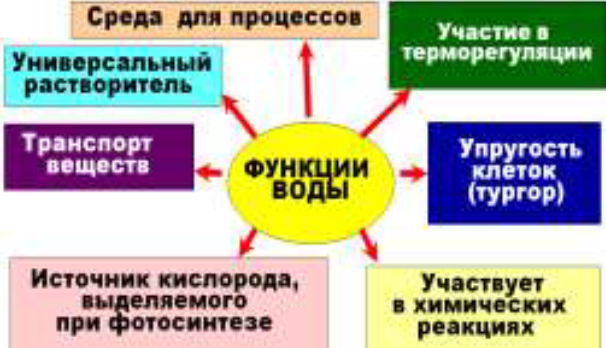
| Биологические функции воды: 1.Вода — универсальный растворитель для полярных веществ. Вода — основная среда перемещения веществ в организме и клетке. Обеспечивает транспорт веществ в клетке и организме. 2. Большая теплоёмкость и теплота парообразования, т.к. для разрыва водородных связей нужно много энергии. Участвует в терморегуляции, охлаждая тело при испарении, обеспечивает равномерное распределение теплоты между тканями и органами организма. 3.Придаёт клетке объем и упругость, Осуществляет осмотические явления (тургор). 4. Участвует в химических реакциях, например: реакции гидролиза белков, жиров; фотолиз воды. |
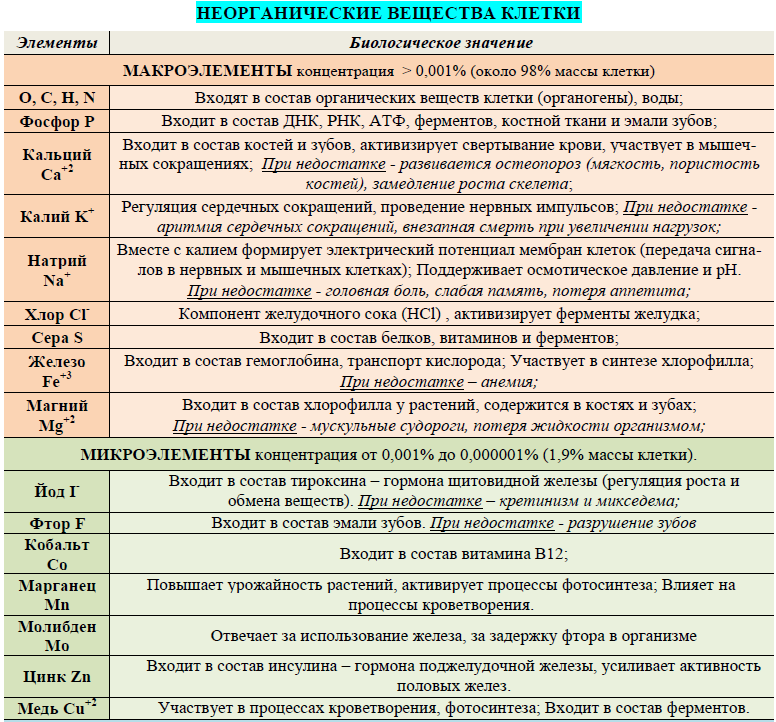
Минеральные соли
Минеральные соединения — соли натрия, калия, кальция — относятся к неорганическим веществам
клетки. В организме соли находятся либовионном состоянии, либов виде твердых соединений.
К неорганическим ионам клетки относятся: катионы K+, Na+, Ca2+, Mg2+, NH4+ и анионы Cl–, NO3-, Н2PO4-, НCO3-, НPO42-.
Функции минеральных солей:
1. Обеспечивают буферность среды, кислотно-щелочное равновесие плазмы, межклеточной жидкости.
Анионы фосфорной кислоты создают фосфатную буферную систему, поддерживающую рН внутриклеточной среды организма на уровне 6—9.
Угольная кислота и ее анионы создают бикарбонатную буферную систему и поддерживают рН внеклеточной среды (плазмы крови) на уровне 7,4.
2. Участвуют в возникновении и проведении нервного импульса. Создают мембранный потенциал клеток (натрий-калиевый насос). Разность между количеством катионов и анионов (Nа+, К+, Сl-) на поверхности и внутри клетки обеспечивает возникновение потенциала действия, что лежит в основе нервного и мышечного возбуждения.
3. Обеспечивают постоянство осмотического давления, поступление воды в клетку (NaCl).
4.Ионы кальция принимают участие в процессах сокращения мышечных волокон и свертывании крови.
5. Ионы магния входят в состав хлорофилла.
6. Ионы железа +2 входят в состав гемоглобина,
7. Нерастворимые соли (СаСО3, Са3(РО4)2) входят в состав костей, зубов, раковин и панцирей.
8. Участвуют в активации ферментов (соляная кислота активирует пепсин).
Органические вещества.
Углеводы или сахара. Общая формула углеводов – Сn (Н2О)n
Моносахариды − это твердыекристаллические вещества, растворимые в воде и имеющие сладкий вкус. Пентозы C5H10O5 — рибоза, входит в состав нуклеотидов РНК;C5H10O4 — дезоксирибоза, входитв состав ДНК ;гексозы C6H12O6 — глюкоза,фруктоза, галактоза.
Дисахариды. Имеют сладкий вкус и хорошо растворимы в воде.
Образованы двумя остатками моносахаридов.
Cахароза (глюкоза + фруктоза) – основной продукт фотосинтеза, транспортируемый в растениях.
Лактоза (глюкоза + галактоза) – входит в состав молока млекопитающих.
Мальтоза (глюкоза + глюкоза) – солодовый сахар, содержится в проросших семенах ячменя, ржи и др. зерновых
Полисахариды: крахмал, гликоген, целлюлоза, хитин. Они не растворимы в воде, не сладкие. Состоят из множества молекул простых углеводов (глюкозы).
Функции углеводов:
Энергетическая
Основной источник энергии для клеточного дыхания.
При расщеплении 1 г углеводов выделяется 17,6 кДж энергии
Структурная
Рибоза и дезоксирибоза – структурные элементы нуклеотидов, являющихся мономерами
РНК и ДНК.
Хитин - основной структурный элемент покровов членистоногих и клеточных стенок грибов.
У растений целлюлоза образует клеточную стенку, выполняют опорную функцию.
Запасающая
Накапливаются в тканях растений (крахмал) и животных и грибов (гликоген). Служат резервом питательных веществ для организмов.
4.Сигнальная (рецепторная) – гликопротеины (гликокаликс) плазматической мембраны обеспечивают формирование и передачу возбуждения.Определяет способность клеток «узнавать» друг друга
Защитная
Секреты, выделяющиеся разными железами, обогащены углеводами, например глюкопротеидами, защищающими стенки полых органов (пищевод, желудок, бронхи) от механических повреждений, проникновения вредных бактерий и вирусов
Липиды
– сборная группа органических соединений, нерастворимых в воде, но хорошо растворимых
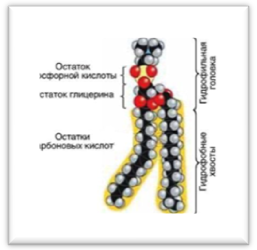 в органических растворителях (эфире, хлороформе, бензине, ацетоне). Именно это свойство делает липиды важнейшими компонентами мембран, так как не позволяет смешивать содержимое клеток.
в органических растворителях (эфире, хлороформе, бензине, ацетоне). Именно это свойство делает липиды важнейшими компонентами мембран, так как не позволяет смешивать содержимое клеток.
Виды липидов:
- жиры (триглицериды)- сложные эфиры высших жирных кислот и глицерина.
- воска,
- стероиды (кортикостерон, половые гормоны)
- фосфолипиды (содержат фосфатную группу- фосфолипиды мембран, холестерин)
Функции липидов:
1. Энергетическая. При полном окислении 1 г жира выделяется 38,9 кДж энергии
2. Запасающая. Жиры откладываются в тканях, формируя резервные энергетические запасы. Запасы жиров могут быть источником метаболической воды (у верблюдов)
3. Защитная. Жировые отложения защищают организм и внутренние органы от механических повреждений. Восковой слой на поверхности растений защищает от испарения.
4. Структурная (строительная) – фосфолипиды входят в состав клеточных мембран.
5. Теплоизоляционная. Жир плохо проводит тепло,подкожный жир помогает сохранить тепло.
6. Являются источниками метаболической воды для живых организмов. При окислении 100 г жира образуется около 105 мл воды. Это свойство жира используется животными пустынь (верблюд) и животными в спячке (медведи, сурки и т. п.).
7. Регуляторная – гормон надпочечников – кортизон и половые гормоны имеют липидную природу.
Белки, их строение и функции
Белки (полипептиды) – это биополимеры, мономерами которых являются аминокислоты, соединенные пептидной связью.
В аминокислотах выделяют:
- аминогруппу - NH2
- карбоксильную группу - СООН
- радикал – разный для всех АК.
В белках встречается 20 видов различных α-аминокислот, некоторые из которых животные синтезировать не могут. Они получают их от растений, которые могут синтезировать все аминокислоты. Именно до аминокислот расщепляются белки в пищеварительных трактах животных. Из этих аминокислот, поступающих в клетки организма, строятся его новые белки.
Структура белковой молекулы.
1. Первичная структура- последовательность аминокислотных
звеньев в полипептидной цепи. Соседние аминокислоты связаны
пептидными связями, возникающими между углеродом
карбоксильной группы одной аминокислоты и азотом аминогруппы
другой аминокислоты. Именно первичная структура определяет свойства молекул белка.
2. Вторичная ( спиралевидная) структура. МеждуСО и NH – группами аминокислотных остатков, соседних витков спирали, возникают водородные связи, удерживающие цепь.
3. Третичная структура скручена (уложена) в виде клубка (глобулы).
Прочность этой структуры обеспечивается гидрофобными, водородными, ионными и дисульфидными S-S связями.
4. Четвертичную структуру образуется при взаимодействии нескольких глобул (третичных структур).
Четвертичная структура так же удерживается слабыми нековалентными связями – ионными, водородными, гидрофобными. Такая структура характерна только для некоторых белков, например, гемоглобина.
СВОЙСТВА БЕЛКОВ
Денатурация белка - процесс нарушения пространственных структур белка под воздействием высокой температуры, радиации, концентрированных кислот и щелочей, тяжелых металлов. Денатурация может быть обратимой и необратимой. При обратимой денатурации происходит восстановление природной структуры белка - ренатурация. Гидролиз - процесс разрушения первичной структуры белков всегда необратим.
В любой клетке есть сотни белковых молекул, выполняющих различные функции. Кроме того, белки имеют видовую специфичность. Это создает серьезные трудности при пересадке органов и тканей от одного человека к другому.
Функции белков.
1.Каталитическая (ферментативная)
Белки – катализаторы (ферменты) ускоряют все биохимические процессы, идущие в клетке.Каждый фермент ускоряет одну и только одну реакцию, обладает специфичностью (например, амилаза превращает крахмал в глюкозу, ДНК-полимераза осуществляет сборку молекул ДНК, липазы расщепляют жиры, каталаза расщепляет ядовитый пероксидводорода). Скорость ферментативных реакций зависит от температуры среды, уровня ее рН, а также от концентраций реагирующих веществ и концентрации фермента. Ферменты действуют в узких температурных пределах, при строго определённых значениях рН среды.
2.Транспортная
Транспортные белки переносят различные вещества, образуя с ними нестойкие соединения. Белки транспортируют ионы через клеточные мембраны (например, гемоглобин переносит кислород и углекислый газ,сывороточный альбумин переносит жирные кислоты).
3.Защитная
Белки-антитела (или иммуноглобулины) обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь. Лизоцим – защита от бактерий.
4.Структурная – одна из основных функций белков. Белки входят в состав клеточных мембран. (например, белок кератин входит в состав волос, ногтей, копыт, коллаген – белок сухожилий, связок, хрящей, актин и миозин – в составе мышц, тубулин – образует микротрубочки, эластин – в составе связок)
5.Сократительная
Сократительные белки (актин, миозин) вызывают мышечное сокращение. Участвуют во всех видах движенияклеток и организма.
6.Сигнальная –отдельные белки клеточных мембран осуществляют прием сигналов и передачу их внутрь клетки. Белки мембран, изменяя структуру, обеспечивают раздражимость клетки.
7.Энергетическая – при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры.
8.Регуляторная (гуморальная).
Белки-регуляторы - белковые гормоны регулируют различныепроцессы в организме (например, инсулин регулирует уровень сахара в крови, адреналин ускоряет работусердца, сужает кровеносные сосуды).
9. Запасающая
Казеин молока, альбумин яиц, запасные белки семян растений.
Нуклеиновые кислоты
Нуклеиновые кислоты - биополимеры, мономерами которых являются нуклеотиды.
В клетках имеются два типа нуклеиновых кислот: дезоксирибонуклеиновая кислота - ДНК и рибонуклеиновая кислота - РНК.
Молекула нуклеотида состоит из трех частей —
- азотистого основания,
- моносахарида (пентозы, сахара)
- остатка фосфорной кислоты.
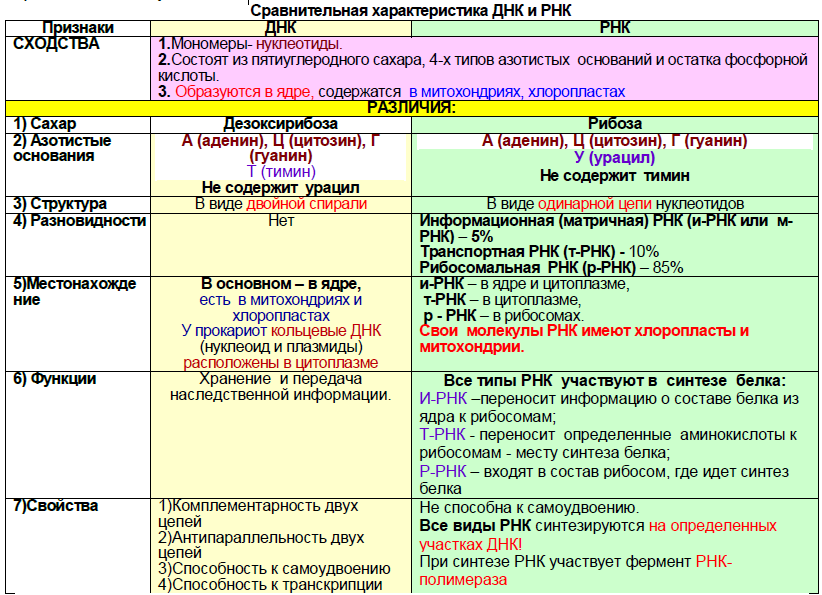
Дезоксирибонуклеиновая кислота (ДНК) – линейный полимер, имеющий вид двойной спирали, образованной паройантипараллельных (то есть против 3ʼ-конца одной цепи находится 5ʼ-конец другой) комплементарных цепей.
Нуклеотиды в молекуле ДНК обращены друг к другу азотистыми основаниями и объединены парами в соответствии с правилами комплементарности: напротив аденина расположен тимин, напротив гуанина – цитозин. Состоит из двух нитей (двойная спираль), которые по всей длине соединены водородными связями, возникающими между азотистыми разных цепочек А = Т; Г ≡ Ц. Эти пары оснований называются комплементарными.
Пара А = Т соединена двумя водородными связями, а пара Г ≡ Ц– тремя.
Азотистые основания, способные образовывать водородные связи друг с другом называют комплементарными.
Две комплементарные цепи в молекуле ДНК расположены в противоположных направлениях -
антипараллельно: одна нить имеет направление от 5' к 3', другая - от 3' к 5'. Молекула ДНК способнасамоудваиваться. Этот процесс называется репликация или редупликация. Ферменты, синтезирующиеновые нити ДНК и называемые ДНК-полимеразами, могут передвигаться вдоль матричных цепей лишь водном направлении от 5'-конца к 3'-концу. Поэтому в процессе репликации одновременный синтез новыхцепей идет антипараллельно.
Последовательность репликации:
1. Раскручивание молекулы ДНК
2. Разделение ферментом двух цепей
3. Комплементарное присоединение ферментом ДНК-полимеразойсвободных нуклеотидов к двум цепям
4. Образование двух молекул ДНК
Репликация ДНК является матричным синтезом, идет на ДНК-матрице.
ДНК служат матрицей для синтеза разных типов молекул РНК в ходе транскрипции.
Последовательность нуклеотидов в молекуле ДНК определяет ее специфичность, а также специфичность белков организма, которые кодируются этой последовательностью. Эти последовательности индивидуальны и для каждого вида организмов, и для отдельных особей.
| ФУНКЦИИ ДНК: 1) Образует хромосомы (в результате спирализации с помощью белков гистонов); 2) Хранение и передача наследственной информации, генетического кода; 3) Кодирует первичную структуру белка; |
4) Участвует в биосинтезе всех типов РНК (является матрицей).
Рибонуклеиновая кислота (РНК) – линейный полимер, состоящий из одной цепи нуклеотидов (исключение вирусы). В составе РНК тиминовый нуклеотид замещен на урациловый (У). Каждый нуклеотид РНК содержит пятиуглеродный сахар – рибозу, одно из четырех азотистых оснований и остаток фосфорной кислоты.
Виды РНК.
Матричная, или информационная РНК. Синтезируется в ядре при участии фермента РНК-полимеразы. Комплементарна участку ДНК, на котором происходит синтез. Ее функция – снятие информации с ДНК и передача ее к месту синтеза белка – на рибосомы. Составляет 5% РНК клетки.
Рибосомная РНК – синтезируется в ядрышке и входит в состав рибосом. Составляет 85% РНК клетки.
Транспортная РНК. Транспортирует аминокислоты к месту синтеза белка. Имеет форму клеверного листа и состоит из 70—90 нуклеотидов.
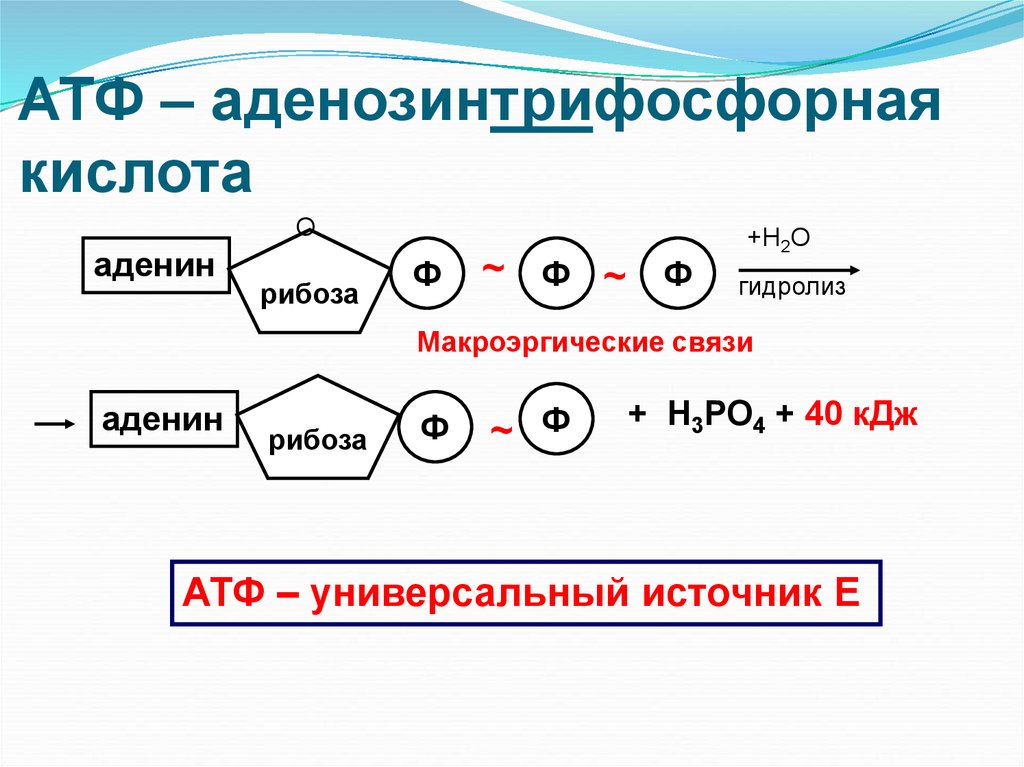 Аденозинтрифосфорная кислота(АТФ) — нуклеотид, в состав которого входит азотистое основание аденин, углевод рибоза и три остаткафосфорной кислоты.В отличие от ДНК и РНК, АТФ не является полимером. АТФ - это особый адениловый мононуклеотид,имеющий особые
Аденозинтрифосфорная кислота(АТФ) — нуклеотид, в состав которого входит азотистое основание аденин, углевод рибоза и три остаткафосфорной кислоты.В отличие от ДНК и РНК, АТФ не является полимером. АТФ - это особый адениловый мононуклеотид,имеющий особые
богатые энергией химические связи. В химических связях между остатками
фосфорной кислоты молекулы АТФ
запасена энергия. Эти связи называются
 макроэргическими. Эти связи неустой-чивые и при их разрыве выделяется энергия.Когда отАТФ отщепляется один остаток фосфорной кислоты, образуется АДФ —аденозиндифосфорная кислота и выделяется 40 кДж энергии.
макроэргическими. Эти связи неустой-чивые и при их разрыве выделяется энергия.Когда отАТФ отщепляется один остаток фосфорной кислоты, образуется АДФ —аденозиндифосфорная кислота и выделяется 40 кДж энергии.
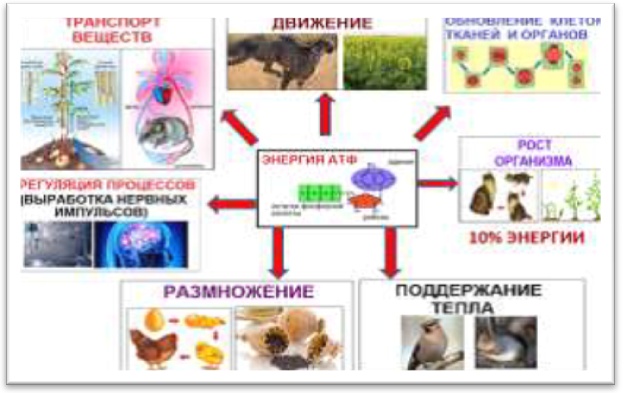
Функции АТФ является биологическим аккумуляторомэнергии, универсальным источником энергии в клетках всехживых организмов.
Место синтеза: наибольшее количество АТФ синтезируется в митохондриях в ходе реакций окислительного фосфорилирования, часть в цитоплазме. У растений в ходе фотосинтеза в световой фазе- в хлоропластах. АТФ есть везде, где необходима энергия для каких-либо процессов.
Ферменты – это белки, ускоряющие процессы в клетке
(биологические катализаторы). В настоящее время изучено более
тысячи ферментов. Каталитическая активность фермента
определяется не всей его молекулой, а только определенной его
частью- активным центром. С ним и связывается субстрат-
вещество, на которое действует фермент.
Характеристики ферментов:
• по природе являются белками
• ускоряют прямую и обратную реакции
• не расходуются в процессе реакции
• ускоряют реакции в миллионы и миллиарды раз
реакция происходит в активном центре фермента, геометрическая форма которого
подходит к субстрату, как «ключ к замку»
• в состав активного центра часто входит небелковый компонент (ионы металлов
(кофакторы) и витамины (коферменты), которые облегчают проведение реакции);
• форма фермента постоянна, а форма субстрата меняется в процессе реакции;
• обладают специфичностью, т.е. осуществляют одну реакцию с одним субстратом (например,
фермент, расщепляющий жиры, не может расщеплять белки)
• обладают узким диапазоном температур (денатурируют и теряют активность при повышении температуры).
Действие фермента: в ходе реакции фермент связывает субстрат, изменяет его конфигурацию,
образуя ряд промежуточных молекул, дающих в конечном итоге продукты реакции.
Активность ферментов зависит от:
· температуры (наиболее активны при темп. 36-38 град.),
· реакции среды;
· концентрации веществ;
· наличия или отсутствия каких-либо веществ (например, витаминов, служащих
коферментами, фермент пепсин в составе желудочного сока активен при присутствии
соляной кислоты).
Действие высоких температур, сильных щелочей и кислот, ядов, радиации приводит к
необратимой денатурации ферментов, разрушению из пептидных связей, что нарушает
обменные процессы и приводит к гибели клеток. Существуют и специальные вещества,
способные снижать активность ферментов - ингибиторы. Они связываются с активными
центрами ферментов и блокируют их активность. В роли ингибиторов могут выступать ионы
тяжелых металлов: свинца (Pb), мышьяка (As) и серебра (Ag).
Примеры ферментов:
· пептидазы (расщепляют белки),
· липазы (расщепляют жиры),
· каталаза (расщепляет в клетках перекись водорода),
· амилаза (расщепляет крахмал до дисахарида мальтозы),
· лактаза(расщепляет молочный сахар-лактозу),
· полимеразы (ускоряют синтез нуклеиновых кислот),
· нуклеазы (расщепляют нуклеиновые кислоты) и др.