Определение жесткости воды
Цель работы - овладение методом количественного анализа воды по показателям постоянной и временной жесткости.
I. ТЕРМИНЫИ ОПРЕДЕЛЕНИЯ
ЖЕСТКОСТЬ ВОДЫ - это показатель природной воды, обусловленный наличием в ней растворенных солей кальция и магния. Измеряется жесткость в миллиграмм-эквивалентах в литре раствора (мг-экв/л) – приведенной величине, учитывающей весовую концентрацию каждого иона в мг/л, его молекулярный вес и электрический заряд. Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность).
Кальциевую и магниевую жесткости можно перевести в весовое содержание этих элементов в воде и наоборот в следующих соотношениях:
МСа = 20,04 ЖСа (мг/л); ЖСа = МСа/20,04 (мг-экв/л)
МMg = 12,16 ЖMg (мг/л); Ж Mg = М Mg/ 12,16 (мг-экв/л)
где М - весовое содержание кальция или магния в миллиграмах на 1 литр.
НОРМАЛЬНЫЙ РАСТВОР содержит в 1 кубическом дециметре (литре) один г-экв растворенного вещества. Для наглядности сравнения нормальной и процентной концентраций рассмотрим подсчет процентности децинормального раствора соляной кислоты. (0,1N НCl), который используется при титровании в данной работе.
Для подсчетов возьмем массовые числа Н(1,008) и Сl(35,45), сложим их (36,458), округлим (36), вычислим 0,1 (3,6). Значит, один литр 0,1N раствора HСl содержит 3,6 г кислоты, а в 100 г этого раствора - 0,36г HCl. Округленно процентность такого раствора - 0,4 %.
ТИТР - вобъемном химическом анализе - концентрация раствора реактива, число граммов вещества в 1 мл раствора.
ТИТРОВАНИЕ - это метод объемного химического анализа, состоящий в постепенном струйно-капельном приливании реактива известной концентрации к известному объему другого реактива, концентрацию которого нужно установить в ходе опыта.

|
ИНДИКАТОР МЕТИЛОВЫЙ ОРАНЖЕВЫЙ, цветовой определитель рН среды.
рН < 3 кислая среда - красный (розовый)
рН = 5,5 нормальная - оранжевый
рН > 7 щелочная - желтый (светло-желтый)
Титрование происходит в присутствии индикатора рН среды, по изменению цвета которого и прекращают титрование. Установка для титрования приведена на рисунке 1. Она состоит из металлического штатива, на котором закреплена стеклянная бюретка с кислотой и колбы с анализируемой жидкостью.
Существует пропорция для вычисления неизвестной концентрации примесей в анализируемой жидкости. Выведем ее из уравнения:
Ca(HCO3)2 + 2HCl = CaCl2 + 2CO2 + 2H2O,
где известна нормальность (0,1) и количество кислоты, пошедшей на титрование. Количество анализируемой жидкости задано условием опыта, но может быть любое. Зная эквивалент Са (20,04), эквивалент соляной кислоты HCl (36,5) и считая, что 1 литр нормального раствора НСl прореагирует с 20,04 г Са2+, принимаем, что 1 мл 0,1N HCl соответствует 2,004 мг Са2+. Установив опытным путем объем кислоты V HCl, пошедший на титрование 50 мл жесткой воды, можно определить количество мг Са2+, содержащегося в этом объеме исследуемой воды, а затем и в литре такой воды, умножив полученную величину на 1000:50=20
1 мл 0,1N HCl ® 2,004 мг Са
V 0,1N HCl ® X мг Са
Рисунок 2 иллюстрирует как правильно проводить отсчет объема жидкости в бюретки: а – правильный отсчет; б – завышенный отсчет; в – заниженный отсчет.
МЕРЫПРЕДОСТОРОЖЕННОСТИ ПРИ ПРОВЕДЕНИИ РАБОТ С ХИМИЧЕСКИМИ РЕАКТИВАМИ
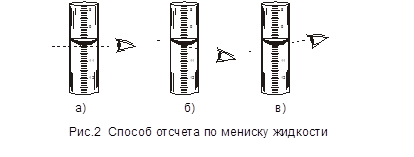
|
1. Работайте всегда на одном и том же месте.
2. Не загромождайте рабочий стол свертками, папками, книгами.
3. Запрещается приносить в лабораторию съестное, напитки, использовать жевательную резинку во время работы.
4. Соблюдать в лаборатории тишину и чистоту.
5. Перед каждой лабораторной работой внимательно изучить теоретический материал по указанной теме.
6. Приступить к опыту только после того, как уяснена его цель и порядок выполнения.
7. Особая осторожность требуется при работе со стеклянной посудой и приборами.

|
8. Децинормальные растворы солей, кислот и щелочей имеют низкую процентную концентрацию, но при работе с ними не следует забывать общие правила предосторожности при работе с химическими веществами.
II. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Суммарное содержание солей кальция и магния называют общей жесткостью. Общая жесткость подразделяется на карбонатную (временную или устранимую) и некарбонатную (постоянную).
 Временная жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния Са(НСО3)2 и Мg(НСО3)2. Соли карбонатной (временной) жесткости устраняют при нагревании воды до 120-150 ºС, при этом образуются осадки карбонатов кальция и магния
Временная жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния Са(НСО3)2 и Мg(НСО3)2. Соли карбонатной (временной) жесткости устраняют при нагревании воды до 120-150 ºС, при этом образуются осадки карбонатов кальция и магния
 Са(НСО3)2 СаСО3↓ + СО2↑+ Н2О
Са(НСО3)2 СаСО3↓ + СО2↑+ Н2О
Мg(НСО3)2 МgСО3↓ + СО2↑+ Н2О
Эта реакция обратима (равновесна), так как при контакте СО2 с раствором можно снова получить кислую соль. Только при кипячении СО2 улетучивается и равновесие смещается в сторону нерастворимой соли.
Остающаяся после кипячения жесткость называется постоянной.
Постоянная жесткость - это жесткость кипяченой воды, вызывается присутствием в воде хлоридов и сульфатов кальция и магния двухвалентных CaSO4, MgSO4, CaCl2, MgCl2.
По величине жесткости различают воду:
· очень мягкую (0–1,5 мг÷экв/л);
· мягкую (1,5–3 мг÷экв/л);
· средней жесткости (3–6 мг÷экв/л);
· жесткую (6–9 мг÷экв/л);
· очень жесткую (более 9 мг÷экв/л).
Общая жесткость колеблется от единиц до десятков, иногда сотен мг-экв/дм3, причем карбонатная жесткость составляет до 70–80% от общей жесткости. Обычно преобладает жесткость, обусловленная ионами кальция (до 70%); однако в отдельных случаях магниевая жесткость может достигать 50–60%.
В естественных условиях ионы кальция, магния и других щелочноземельных металлов, обуславливающих жесткость, поступают в воду в результате взаимодействия растворенного диоксида углерода с карбонатными минералами и других процессов растворения и химического преобразования горных пород. Источником этих ионов являются также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
Мягкими являются воды Севера, дождевые, талые, фильтрующиеся через кристаллические породы. Повышенной жесткостью обладают воды, фильтрующиеся через известняки, доломиты, гипс. Жесткость морской воды и океанов значительно выше (десятки и сотни мг-экв/дм3). Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья.
Наилучшие вкусовые свойства имеет вода с жесткостью 1,6–3,0 мг÷экв/л, а, согласно СанПиН 2.1.4.1116–02, физиологически полноценная вода должна содержать солей жесткости на уровне 1,5–7 мг÷экв/л. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая действие на органы пищеварения, провоцирует отложения солей в суставах (полиартриты, остеохондрозы), нарушает обменные процессы в организме. Ионы кальция и магния омыляют жиры, нарушая процессы всасывания питательных веществ в кишечнике, вызывая дерматиты. Повышенное содержание кальция в питьевой воде на фоне йодной недостаточности вызывает заболевания щитовидной железы. Повышенное содержание магния снижает моторику кишечника, препятствуя пищеварительному процессу. Пониженное содержание солей жесткости (ВОЗ ограничивает нижний допустимый предел 1,5 мг.экв/л) также опасно и вызывает у населения кариес и ослабление костей скелета, так как организм в этом случае восполняет недостаток кальция засчет внутренних ресурсов.
Допустимая жесткость промышленных вод различна для разных производств. При жесткости воды выше 4,5 мг÷экв/л происходит интенсивное накопление осадка в системе водоснабжения и на сантехнике, нарушается работа бытовых приборов. Обычно умягчение проводят до остаточной жесткости 1,0–1,5 мг÷экв/л, что соответствует зарубежным нормативам по эксплуатации бытовой техники. Вода, имеющая жесткость ниже 0,5 мг÷экв/л является коррозионно-активной по отношению к трубам и котлам, способна вымывать отложения в трубах, накапливающиеся при долгом застаивании воды в системе водоснабжения. Это влечет за собой появление неприятных запаха и вкуса воды. Для пищевой промышленности опасны как повышенные, так и пониженные значения жесткости, поэтому предпочитается интервал от 5 до 7 единиц.