Опыты к экзаменационным билетам
Билет №1
Получение и собирание оксида углерода (IV). Проведение реакций, подтверждающих его характерные свойства.
Оксид углерода (IV) иначе называется углекислый газ. Получить углекислый газ можно несколькими путями. Например, разложением малахита (карбонат гидроксомеди) (CuOH)2CO3.
(CuOH)2CO3 → CuO + H2O + CO2↑
Или при взаимодействии карбонатов с более сильными кислотами (соляной).
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Проведение эксперимента:
1. Поместите в пробирку несколько кусочков мрамора и прилейте немного разбавленной соляной кислоты.
2. Пробирку быстро закройте пробкой с газоотводной трубкой. Конец трубки поместите в другую пробирку в которой находится 2 – 3 мл раствора гидроксида кальция. Несколько минут продолжайте пропускать газ. (В пробирке наблюдается выпадение осадка, затем осадок может исчезнуть).
3. Выньте из раствора конец газоотводной трубки, сполосните его водой. Опустите его в стакан с водой, который предварительно добавлен метиловый оранжевый. (Раствор из оранжевого становится красным).
Для комиссии:
1. Написать уравнение взаимодействия карбоната кальция и соляной кислоты в молекулярном и ионном видах.
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
CaCO3 + 2H+ → Ca2+ + H2O + CO2↑
2. Написать уравнение взаимодействия углекислого газа и гидроксида кальция. Не забыть указать в нём осадок.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Наблюдается выпадение белого мелкокристаллического осадка
CaCO3↓ + H2O + CO2 → Ca(HCO3)
Наблюдается растворение осадка.
3. Написать уравнение взаимодействия углекислого газа и воды. Уравнение диссоциации угольной кислоты. Дать объяснение наблюдаемым явлениям.
CO2 + H2O ↔ H2CO3
H2CO3 ↔ H+ + HCO3–
Метиловый оранжевый является кислотно-основным индикатором, то есть изменяет окраску в кислой и щелочных средах. В кислой среде, которую создаёт взаимодействие углекислого газа с водой (что написано в уравнениях), метиловый оранжевый становится красным.
Билет №2
Проведение реакций, характерных для кислот (на примере хлороводородной кислоты).
Являясь сильной кислотой, хлороводородная кислота может диссоциировать в водных растворах, образуя сильнокислую среду. Она так же может взаимодействовать с большим числом различных веществ:
· металлами, стоящими в ряду напряжения до водорода;
· основаниями, и с растворимыми, и с нерастворимыми;
· основными и амфотерными оксидами;
· солями более слабых и летучих кислот.
Посмотрим, что происходит при взаимодействии перечисленных веществ с соляной кислотой.
Проведение эксперимента:
В 4 пробирки поместить следующие вещества:
1. раствор соляной кислоты и несколько капель метилового оранжевого;
2. гранулу цинка (стружку магния, гранулу алюминия) и раствор соляной кислоты, нагреть;
3. раствор гидроксида натрия, несколько капель фенолфталеина (раствор станет малиновым) и раствор соляной кислоты;
4. карбонат натрия (раствор) или карбонат кальция и раствор соляной кислоты (выделение пузырьков газа).
Для комиссии:
Написать все уравнения реакций в молекулярном и ионном видах. Где необходимо, указать окислитель и восстановитель. Написать реакции взаимодействия кислоты с нерастворимым основанием (можно взять амфотерное), основным и амфотерным оксидом.
1. HCl → H+ + Cl-
Наблюдается изменение окраски индикатора оранжевый → красный.
2. Zn + 2HCl → ZnCl2 + H2↑
| восстановитель | Zn0 – 2e → Zn2+ | процесс окисления |
| окислитель | 2H+ +2e → H20 | процесс восстановления |
Наблюдается выделение пузырьков газа (водород).
3. NaOH(+ф/ф) + HCl → NaCl + H2O
OH- + H+ → H2O
Произойдёт обесцвечивание малинового раствора гидроксида натрия, так как образуется хлорид натрия, чей раствор бесцветный.
4. Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
CO32- + 2H+ → CO2↑ + H2O
Наблюдается выделение пузырьков газа (углекислый газ).
5. Дополнительные уравнения:
Ярким примером амфотерных гидроксидов является гидроксид алюминия (он же нерастворимый гидроксид).
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + 3H+ → Al3+ + 3H2O
Оксид алюминия также обладает амфотерными свойствами.
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 6H+ → 2Al3+ + 3H2O
Для примера реакции с основным оксидом выберем оксид магния.
MgO + 2HCl → MgCl2 + H2O
MgO + 2H+ → Mg2+ + H2O
Билет №3
Получение и собирание кислорода. Доказательство наличия этого газа в сосуде.
Для получения кислорода можно использовать разложение ряда веществ:
· разложение воды под действием постоянного тока 2H2O → 2H2↑ + O2↑;
· разложение перекиси водорода 2H2O2 → 2H2O + O2↑;
· разложение хлората калия 2KClO3 → 2KCl + 3O2↑;
· разложение перманганата калия 2KMnO4 → K2MnO4 + MnO2 + O2↑.
Для получения кислорода мы будем использовать реакцию разложения перманганата калия. Для этого необходимо собрать установку для собирания кислорода методом вытеснения воздуха:
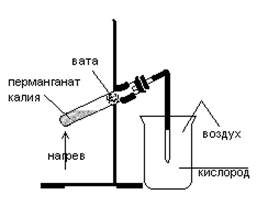
Наличие кислорода в сосуде можно доказать таким образом: опустить в сосуд тлеющую лучину; она вновь разгорится.
Для комиссии:
1. Написать (или хотя бы перечислить) все уравнения разложения, указать окислитель и восстановитель для реакции с перманганатом калия.
2KMnO4 → K2MnO4 + MnO2 + O2↑
| восстановитель | 2O2- – 4e → O20 | процесс окисления |
| окислитель | Mn+7 + e → Mn+6 Mn+7 + 3e → Mn+4 | процесс восстановления |
2. Собрать установку.
3. Получить кислород.
4. Доказать его наличие.
Билет №4
Проведение реакций, характеризующих свойства нерастворимых оснований (на примере гидроксида меди (II)).
Нерастворимые основания обладают следующими свойствами:
· они могут реагировать с сильными кислотами;
· и разлагаются при нагревании.
Рассмотрим эти свойства на примере гидроксида меди (II). Для этого получим гидроксид меди по реакции раствора сульфата меди с раствором гидроксида натрия (выпадает творожистый осадок ярко-голубого цвета):
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
Cu2+ + 2OH- → Cu(OH)2↓
Разделим образовавшийся осадок на две части (см. рисунок).

В первую пробирку добавим серную кислоту (осадок растворяется), вторую пробирку нагреем над пламенем спиртовки (образуется чёрный осадок оксида меди (II) и вода).
Уравнения реакций:
1. Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Cu(OH)2 + 2H+ → Cu2+ + 2H2O
2. Cu(OH)2 → CuO + H2O
Для комиссии:
1. Написать все уравнения реакций, для первого и второго ионные уравнения.
2. Провести реакции в соответствии с правилами техники безопасности.
3. Объяснить наблюдаемые явления.
Билет №5
Проведение реакций, подтверждающих качественный состав выданной соли (например, хлорида меди (II)).
Для подтверждения качественного состава соли необходимо провести качественные реакции, подтверждающие наличие искомых ионов в растворе. Подтвердим состав хлорида меди (II).
В растворе хлорид меди (II) диссоциирует согласно уравнению:
CuCl2 → Cu2+ + 2Cl-
Таким образом, необходимо подтвердить наличие в растворе ионов меди и ионов хлора.
1. Качественной реакцией на ион меди является сама окраска раствора соли. Растворы солей меди имеют характерный голубой цвет.
CuCl2 → Cu2+(голубой раствор) + 2Cl-
2. Кроме того, к раствору соли можно добавить раствор гидроксида натрия (выпадет ярко-голубой творожистый осадок). Уравнение реакции:
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Cu2+ + 2OH- → Cu(OH)2↓
3. Также можно использовать окислительно-восстановительные свойства ионов меди. То есть, опустить в раствор соли железный гвоздь, который через некоторое время покроется слоем меди (металл красно-бурого цвета). При этом протекает окислительно-восстановительная реакция.
Fe + CuCl2 → FeCl2 + Cu
| восстановитель | Fe0 – 2e → Fe2+ | процесс окисления |
| окислитель | Cu2+ + 2e → Cu0 | процесс восстановления |
4. Для подтверждения наличия иона хлора проводят реакцию с раствором нитрата серебра. Происходит выпадение белого мелкокристаллического осадка. Уравнение реакции:
CuCl2 + 2AgNO3 → Cu(NO3)2 + 2AgCl↓
2Cl- + 2Ag+ → 2AgCl↓
Для комиссии:
1. Из второго и третьего уравнений выбрать способ качественного определения меди (остальные описать словами).
2. Написать уравнение реакции диссоциации, молекулярные и ионные уравнения, окислительно-восстановительные реакции.
3. Провести реакции в соответствии с правилами техники безопасности.
4. Объяснить наблюдаемые явления.
Билет №6
Получение и собирание водорода. Доказательство наличия этого газа в приборе.
В лаборатории водород получают взаимодействием металлов средней активности (от магния до водорода) с кислотой (серной или соляной).
Получим водород взаимодействием цинка (обычно, для быстрой реакции, берут магний) с соляной кислотой. Для этого в пробирку поместим несколько гранул цинка (стружек магния), нальём кислоту. (Пробирка закрывается пальцем до получения необходимого количества водорода.)
Уравнение реакции:
Zn + 2HCl → ZnCl2 + H2↑
| восстановитель | Zn0 – 2e → Zn2+ | процесс окисления |
| окислитель | 2H+ +2e → H20 | процесс восстановления |
Если реакция идет медленно, то реакционную смесь необходимо нагреть. Для этого пробирку укрепляют в лапке, устанавливают снизу спиртовку и недолго нагревают пробирку. (До бурного выделения пузырьков газа).
Для доказательства наличия водорода в пробирке, куда мы её собирали, необходимо к горлышку пробирки поднести горящую спичку (если послышится лающий хлопок, то это взрывается загрязнённый водород, а чистый водород горит синем пламенем).
Уравнение реакции:
2H2 + O2 → 2H2O
Для комиссии:
1. Написать все уравнения реакций, указать окислитель и восстановитель.
2. Провести реакции в соответствии с правилами техники безопасности.
3. Объяснить наблюдаемые явления.
Билет №7
Выделение чистой поваренной соли из выданной смеси ее с речным песком.
Часто вещества нуждаются в очистке. Посмотрим пример очистки поваренной соли от речного песка.
Очистка поваренной соли от песка основывается на различных физических свойствах данных веществ. Во-первых, соль и песок обладают различной растворимостью в воде, во-вторых, раствор соли легко проникает через поры фильтровальной бумаги. Поэтому первая часть разделения данной смеси происходит следующим образом, в стакане в небольшом количестве воды растворяют максимальное количество смеси песка и соли, полученный раствор фильтруют через бумажный фильтр (раствор через поры проходит, а песок – нет).

После получения чистого раствора соли возникает необходимость разделения соли и воды. Для этого используют метод выпаривания. Раствор наливают в чашку для выпаривания (не более 1/3 чашки) и аккуратно нагревают над пламенем спиртовки (см. рисунок). Со временем вода испаряется, соль остаётся.

Для комиссии:
1. Провести опыт в соответствии с правилами техники безопасности.
2. Объяснить наблюдаемые явления.
Билет №8
Проведение реакций, позволяющих осуществить следующие превращения:
растворимая соль → нерастворимое основание → оксид металла.
Цепочку данных превращений можно проследить на примере соли меди (II).
1. При добавлении к ней щёлочи образуется нерастворимое основание гидроксида меди (II) (выпадет голубой осадок).
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Cu2+ + 2OH- → Cu(OH)2↓
2. При нагревании образовавшийся гидроксид разлагается на оксид металла и воду.
Cu(OH)2 → CuO + H2O
Для комиссии:
1. Написать все уравнения реакций, для первого молекулярное и ионное уравнения.
2. Провести реакции в соответствии с правилами техники безопасности.
3. Объяснить наблюдаемые явления.
Билет №9
Распознавание с помощью характерных реакций соли серной кислоты среди трех выданных растворов солей (нитрат натрия, сульфат натрия, хлорид натрия).
Для распознавания соли серной кислоты существует качественная реакция на сульфат-ион. Это взаимодействие данного иона с ионами бария (в молекулярном выражении с растворимыми солями бария или гидроксидом бария).
Ba(NO3)2 + Na2SO4 → BaSO4↓ + 2NaNO3
Ba2+ + SO42- → BaSO4↓
В результате этого взаимодействия выпадает белый мелкокристаллический осадок. В других случаях (нитрат натрия, хлорид натрия) осадок не образуется.
Проведение эксперимента.
В каждую из выданных пробирок налить по небольшому количеству раствора нитрата бария, отметить, в какой выпал осадок. Эта пробирка будет содержать соль серной кислоты.
Для комиссии:
1. Написать все уравнения реакций в молекулярном и ионном видах.
2. Провести реакции в соответствии с правилами техники безопасности.
3. Объяснить наблюдаемые явления.
Билет №10
Проведение реакций, подтверждающих качественный состав выданной кислоты (серной или соляной).
Предложены примеры сильных кислот, которые при диссоциации распадаются на ионы:
H2SO4 → 2H+ + SO42-
HCl → H+ + Cl-
Для обнаружения этих ионов можно использовать следующие реакции:
образовавшаяся кислая среда (наличие ионов водорода в растворе) определяется с помощью индикаторов:
| Индикатор | Переход окраски |
| универсальная индикаторная бумага | становится красной |
| метиловый оранжевый | оранжевый → красный |
| лакмус | тёмно-синий→красный |
качественная реакция на сульфат ионы – взаимодействие с солями бария. В результате этого взаимодействия выпадает белый мелкокристаллический осадок.
Ba(NO3)2 + H2SO4 → BaSO4↓ + 2HNO3
Ba2+ + SO42- → BaSO4↓
Для подтверждения наличия ионов хлора используют нитрат серебра.
AgNO3 + HCl → AgCl↓ + HNO3
Ag+ + Cl- → AgCl↓
В результате реакции выпадает белый мелкокристаллический осадок хлорида серебра.
Проведение эксперимента:
Выбрать кислоту или использовать предложенную. Из банки с кислотой в пробирку наливают немного раствора, затем опускают туда кончик индикаторной бумаги, демонстрируют результат комиссии. Или капают несколько капель указанного индикатора (демонстрируют результат комиссии). Затем наливают небольшое количество соли бария или серебра и демонстрируют комиссии осадок.
Для комиссии:
1. Написать уравнение реакции диссоциации, для второго молекулярное и ионное уравнения.
2. Провести реакции в соответствии с правилами техники безопасности.
3. Объяснить наблюдаемые явления
Билет №11
Определение с помощью характерной реакции соли хлороводородной кислоты среди трех выданных растворов солей (хлорида натрия, сульфата натрия, нитрата натрия).
Для распознавания соли хлороводородной кислоты существует качественная реакция на хлорид-ион. Это взаимодействие данного иона с ионами серебра (в молекулярном выражении с растворимыми солями серебра, обычно нитратом серебра).
AgNO3 + HCl → AgCl↓ + HNO3
Ag+ + Cl- → AgCl↓
В результате этого взаимодействия выпадает белый мелкокристаллический осадок. В других случаях (нитрат натрия, сульфат натрия) осадок не образуется.
Проведение эксперимента.
В каждую из выданных пробирок налить по небольшому количеству раствора нитрата серебра, отметить, в какой выпал осадок. Эта пробирка будет содержать соль хлороводородной кислоты.
Для комиссии:
1. Написать все уравнения реакций в молекулярном и ионном видах.
2. Провести реакции в соответствии с правилами техники безопасности.
3. Объяснить наблюдаемые явления.
Билет №12
Распознавание кислоты и щелочи среди трех выданных веществ (гидроксид натрия, соляная кислота, хлорид натрия).
Кислоту и щёлочь легко определить с помощью индикатора.
| Индикатор | Цвет в нейтральной среде | Цвет в кислой среде | Цвет в щелочной среде |
| универсальная индикаторная бумага | жёлтый | красный | синий |
| метиловый оранжевый | оранжевый | красный | жёлтый |
| фенолфталеин | бесцветный | бесцветный | малиновый |
| лакмус | фиолетовый | красный | синий |
Третье вещество – соль, которая не может окрашивать индикаторы.
HCl → H+ + Cl- (кислая среда)
NaOH → OH- + Na+ (щелочная среда)
NaCl → Na++ Cl- (нейтральная среда)
Выберите наиболее подходящий на ваш взгляд индикатор, добавьте его во все 3 пробирки. По результатам визуального исследования объясните, где какое вещество.
Для комиссии:
1. Написать уравнения реакций диссоциации.
2. Провести реакции в соответствии с правилами техники безопасности.
3. Объяснить наблюдаемые явления.
Билет №13
Распознавание с помощью характерной реакции соли угольной кислоты среди трех выданных солей (сульфат натрия, карбонат натрия, хлорид натрия).
Для распознавания соли угольной кислоты существует качественная реакция на карбонат-ион. Это взаимодействие данного иона с ионами водорода (в молекулярном выражении с сильными кислотами). Происходит выделение пузырьков газа. Это происходит потому, что угольная кислота очень слабая, и сильные кислоты вытесняют её из соли.
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
CO32- + 2H+ → H2O + CO2↑
Отметив, в какой пробирке выделился газ, можно определить, где карбонат натрия.
Для комиссии:
1. Написать все уравнения реакций в молекулярном и ионном видах.
2. Провести реакции в соответствии с правилами техники безопасности.
3. Объяснить наблюдаемые явления.
Билет №14
Получение реакцией обмена нерастворимого основания и проведение реакций, характеризующих его свойства.
Этот билет полностью аналогичен №7 (проведение реакций, характеризующих свойства нерастворимых оснований).
Нерастворимые основания обладают следующими свойствами:
· они могут реагировать с сильными кислотами;
· и разлагаются при нагревании.
Рассмотрим эти свойства на примере гидроксида меди (II). Для этого получим гидроксид меди по реакции раствора сульфата меди с раствором гидроксида натрия (выпадает творожистый осадок ярко-голубого цвета):
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
Cu2+ + 2OH- → Cu(OH)2↓
Разделим образовавшийся осадок на две части (см. рисунок).

В первую пробирку добавим серную кислоту (осадок растворяется), вторую пробирку нагреем над пламенем спиртовки (образуется чёрный осадок оксида меди (II) и вода).
Уравнения реакций:
1. Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Cu(OH)2 + 2H+ → Cu2+ + 2H2O
2. Cu(OH)2 → CuO + H2O
Для комиссии:
1. Написать все уравнения реакций, для первого и второго ионные уравнения.
2. Провести реакции в соответствии с правилами техники безопасности.
3. Объяснить наблюдаемые явления.
Билет №15
Получение названной соли реакцией обмена (сульфат бария).
Чтобы получить соль реакцией обмена, необходимо определить, из каких ионов она образуется (скорее всего, это осадок). Затем подобрать растворимые соли или другие электролиты, при взаимодействии которых образуется эта соль.
Например: получить соль сульфат бария.
Ba2+ + SO42- → BaSO4↓
Для получения этой соли возьмём растворимую соль бария (например, нитрат) и растворимый сульфат (например, натрия). Запишем уравнение реакции.
Ba(NO3)2 + H2SO4 → BaSO4↓ + 2HNO3
Билет №16
Проведение реакций, характерных для кислот (на примере серной кислоты).
Являясь сильной кислотой, серная кислота может диссоциировать в водных растворах, образуя сильнокислую среду. Она так же может взаимодействовать с большим числом различных веществ:
· металлами, стоящими в ряду напряжения до водорода;
· основаниями, и с растворимыми, и с нерастворимыми;
· основными и амфотерными оксидами;
· солями более слабых и летучих кислот.
Посмотрим, что происходит при взаимодействии перечисленных веществ с серной кислотой.