Расчет и построение кривых титрования
Различают три типа кривых кислотно – оснóвного титрования
1. титрование сильной кислоты сильным основанием (или наоборот)
2.титрование слабой кислоты сильным основанием
3.титрование слабого основания сильной кислотой
(слабую кислоту слабым основанием (или наоборот) титровать нельзя)
1. Расчет и построение кривых титрования одноосновных сильных кислот сильными основаниями и наоборот
А. Титрование раствора сильной кислоты сильным основанием
До ТЭ  значение рН практически определяется только ионами водорода за счет неоттитрованной кислоты.
значение рН практически определяется только ионами водорода за счет неоттитрованной кислоты.

Если разбавлением титруемого раствора можно пренебречь ( ), то
), то
преобразуется к виду
 и
и 
В ТЭ τ=100% вся кислота полностью прореагировала со щелочью.
Значение рН раствора определяется автопротолизом воды:
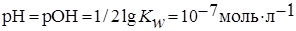 ,
,
где  – ионное произведение воды.
– ионное произведение воды.
После ТЭ τ>100% наблюдается только избыток титранта. Равновесная концентрация гидроксид ионов [OH─] рассчитываетсяпо одному из вариантов

Если ( ), то разбавлением титруемого раствора можно пренебречь.
), то разбавлением титруемого раствора можно пренебречь.
Тогда


Концентрацию ионов водорода рассчитывают из соотношения:
 а
а 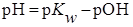
Б. Титрование раствора сильного основания сильной кислотой
До ТЭ 


Если разбавлением титруемого раствора можно пренебречь ( ), то выражение преобразуется к виду:
), то выражение преобразуется к виду:
 и
и 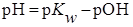
В ТЭ (как и при титровании кислоты) 
После ТЭ τ>100% наблюдается только избыток титранта (кислоты).

Таблица. Значения рН при титровании 0.1 М и 0.01 М растворов
Хлороводородной кислоты соответственно 0.1 М и 0.01 М растворами
Гидроксида натрия без учета изменения объема раствора в процессе титрования
| τ,% | Не оттитро-вано Н+,% | Избыток ОН─,% | Формула расчета 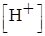 , ,

| рН при титро- вании 0.1М HCl | рН при титро- вании 0.01М HCl |
| 100.0 | ─ |  = c o = c o
| 1.0 | 2.0 | |
| 50.0 | 50.0 | ─ | 
| 1.3 | 2.3 |
| 90.0 | 10.0 | ─ | То же | 2.0 | 3.0 |
| 99.0 | 1.0 | ─ | То же | 3.0 | 4.0 |
| 99.9 | 0.1 | ─ | То же | 4.0 | 5.0 |
| 100.0 | ─ | ─ | 
| 7.0 | 7.0 |
| 100.1 | ─ | 0.1 | 
| 10.0 | 9.0 |
| 101.0 | ─ | 1.0 | То же | 11.0 | 10.0 |
| 110.0 | ─ | 10.0 | То же | 12.0 | 11.0 |
| 150.0 | ─ | 50.0 | То же | 12.7 | 11.7 |
2. Расчет и построение кривых титрования одноосновных слабых
кислот сильным основанием
(на примере титрования уксуснойкислоты стандартным раствором NaOH)
При этом следует помнить, что:
А) равновесная концентрация ионов водорода не равна аналитической
концентрации кислоты: 
Б) в процессе титрования образуется буферный раствор, состоящий из смеси слабой кислоты  и сопряженного основания
и сопряженного основания  (из смеси слабой кислоты и ее соли);
(из смеси слабой кислоты и ее соли);
В) в ТЭраствор содержит только основание  (анион кислоты) в количестве, равном количеству титруемой кислоты.
(анион кислоты) в количестве, равном количеству титруемой кислоты.
Поэтому схема расчета значения pH для каждой точки кривой титрования включает:
1. Определение состава раствора
2. Рассмотрение возможных протекающих реакций
3. Вывод расчетных формул, исходя из значений:
– константы (констант) кислотности
– константы (констант) оснóвности, аналитических и равновесных
концентраций компонентов.
Для расчета значений pH в различных точках кривой титрования и ее построения необходимо вывести четыре формулы для:
1 расчета  ; (pH) раствора слабой кислоты перед началом титрования;
; (pH) раствора слабой кислоты перед началом титрования;
2 расчета  ; (pH) в процессе титрования в интервале 0 < τ < 100%, когда в растворе присутствует слабая кислота и ее соль, образуя буферный раствор;
; (pH) в процессе титрования в интервале 0 < τ < 100%, когда в растворе присутствует слабая кислота и ее соль, образуя буферный раствор;
3 расчета  ; (pH) в точке эквивалентности (стехиометричности), когда в растворе находится только соль слабой кислоты и сильного основания;
; (pH) в точке эквивалентности (стехиометричности), когда в растворе находится только соль слабой кислоты и сильного основания;
4 расчета  ; (pH) после точки эквивалентности (стехиометричности).
; (pH) после точки эквивалентности (стехиометричности).
В соответствии с приведенной схемой рассмотрим процесс титрования раствора  стандартным раствором NaOH.
стандартным раствором NaOH.
1. Перед титрованием (τ=0) в растворе находится только слабая кислота(другими источниками ионов водорода можно пренебречь) и имеет место равновесие:
 , где
, где 
Поскольку степень диссоциации кислоты мала (<5%), то можно полагать, что равновесная концентрация недиссоциированной кислоты равна ее общей концентрации  . Из указанных положений и костанты кислотности следует
. Из указанных положений и костанты кислотности следует
 и
и 
2. При титровании до ТЭ в области 0 < τ <100% образуется буферный раствор,
в котором сосуществуют равновесия:


подавляющие друг друга при достаточно высоких концентрациях 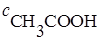 и
и  (образующейся соли). Поэтому можно считать, что
(образующейся соли). Поэтому можно считать, что  , а
, а  . Используя выражение,
. Используя выражение,
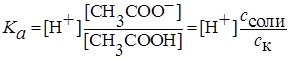
и, пренебрегая вкладом  за счет диссоциации воды, получают:
за счет диссоциации воды, получают:


Концентрацию кислоты можно рассчитать по формуле:

Учитывая, что количество образовавшейся соли равно количеству добавленной щелочи, концентрация соли рассчитывается по формуле:
 ,
,

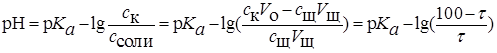
где  – исходная концентрация кислоты и
– исходная концентрация кислоты и 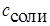 – концентрация соли
– концентрация соли
(образовавшегося сопряженного основания).
3. В ТЭ растворсодержит только сопряженное основание  с ярко выраженными оснóвными свойствами в количестве, равном исходному количеству титруемой кислоты
с ярко выраженными оснóвными свойствами в количестве, равном исходному количеству титруемой кислоты
 ,
,
где  и
и 
Рассматриваемому равновесию соответствует константа основности:

Выражение для константы оснóвности можно записать и в другом варианте: 
Приравнивая правые части выражений друг к другу, получают расчетную формулу для расчета концентрации  :
:
 Þ
Þ  .
.
Откуда равновесная концентрация ионов  равна
равна


Тогда расчетная формула для  имеет вид
имеет вид

где,  , т.к. в ТЭ количество образовавшейся соли равно
, т.к. в ТЭ количество образовавшейся соли равно
количеству исходной кислоты. Если расчет значения  вести без учета разбавления объема, полагая, что
вести без учета разбавления объема, полагая, что 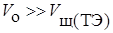 , то
, то  .
.
После ТЭ (τ>100%) раствор представляетсобой смесь слабого  и сильного (NaOH) оснований. Болеесильное основание подавляет диссоциацию слабого основания.
и сильного (NaOH) оснований. Болеесильное основание подавляет диссоциацию слабого основания.

 ,
,
а при  ,где
,где  – концентрация титранта (стандартного раствора щелочи):
– концентрация титранта (стандартного раствора щелочи): 
Пример. Рассчитать и построить кривую титрования 10 мл 0.1М раствора уксусной кислоты 1.0М раствором гидроксида натрия. В данном расчете изменением объема можно пренебречь, т.к. исходные концентрации растворов ( ) различаются в 10 раз.
) различаются в 10 раз.

Рис. - Кривая титрования 0.10 М CH3COOH 1.0 М раствором NaOH
Табл. - Расчет кривой титрования 0.1М раствора СН3СООН 1.0 р-ром NaOH
| Добавлено титранта NaOH,τ,% | Осталось неоттитро-ванной кислоты, (100−τ),% | Состав раствора |
Расчет [H+],  , ,
| рН |
| СН3СООН | 
| 2,88 | ||
СН3СООН 50%
 50% 50%
| 
| 4,76 | ||
СН3СООН 10%
 90% 90%
| 
| 5,76 | ||
СН3СООН 1%
 99% 99%
| 
| 6,76 | ||
| 99,9 | 0,1 | СН3СООН 0,1%
 99,9 99,9
| 
| 7,76 |
 100% 100%
| 
| 8,88 | ||
| 100,1 | Избыток NaOH, (τ−100) 0,1 |  100%
NaOH 0,1% 100%
NaOH 0,1%
| 

| |
 100%
NaOH 1% 100%
NaOH 1%
| 

| |||
 100%
NaOH 10% 100%
NaOH 10%
| 
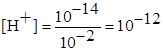
|
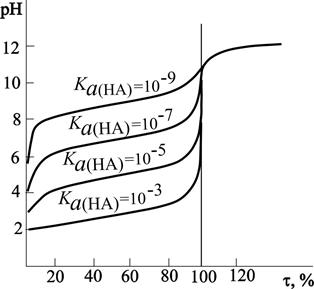
Рис. 4.7. Связь между константой кислотности титруемой кислоты и величиной скачка титрования. Каждая кривая соответствует титрованию 0.1 М раствора кислоты 0.1 М раствором.
3. Расчет и построение кривых титрования одноосновных слабыхоснований сильными кислотами
(на примере титрования водного раствора аммиака хлороводородной кислотой).
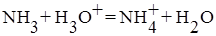
Перед титрованием (τ = 0) в растворе находится только слабое основание (другими источниками гидроксид ионов можно пренебречь) и имеет место равновесие:
 ), где
), где 
Поскольку степень диссоциации основания мала (<5%), то можно полагать, что равновесная концентрация недиссоциированного основания равна его общей концентрации  . Из указанных положений и константы оснóвности (в случае водного раствора аммиака
. Из указанных положений и константы оснóвности (в случае водного раствора аммиака  ) можно записать:
) можно записать:

Отсюда  ,а
,а 
и 
где  ─ исходная концентрация водного раствора аммиака, а
─ исходная концентрация водного раствора аммиака, а  константа оснóвности.
константа оснóвности.
При титровании до ТЭ в области 0 < τ <100% образуется буферный
раствор, состоящий из смеси слабого основания и сопряженной кислоты, в
котором сосуществуют равновесия:


подавляющие друг друга при достаточно высоких концентрациях  и
и  (образующейся соли). Поэтому можно считать, что
(образующейся соли). Поэтому можно считать, что 
( ─ молярная концентрация основания) и
─ молярная концентрация основания) и  (
( ─
─
молярная концентрация образовавшейся сопряженной слабой кислоты).
Исходя из зависимости:
 ,
,
рассчитывают  ,
,
а 
После несложных операций получают варианты расчетных формул:

и 
где  ─ константа кислотности:
─ константа кислотности:  ;
;  ;
;  .
.
В ТЭ (τ = 100%) раствор содержит только слабую сопряженную кислоту  в количестве, равном исходному количеству титруемого основания:
в количестве, равном исходному количеству титруемого основания:
 ,т.е. концентрация
,т.е. концентрация  ,
,
а  .
.
Из выражения константы кислотности:

следует 
где  и в общем случае
и в общем случае


Если 

Если с о = с Т, то
 или
или 
Соответственно 
После ТЭ (τ > 100%) концентрация ионов водорода и величина рН раствора определяются избытком добавленного титранта (сильной кислоты) и расчет ведется по одному из вариантов:
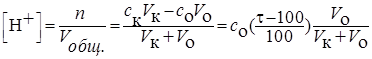
или 
Если концентрация кислоты значительно выше концентрации основания, то множитель  мало отличается от единицы и разбавлением раствора в процессе титрования можно пренебречь. Тогда:
мало отличается от единицы и разбавлением раствора в процессе титрования можно пренебречь. Тогда:
 и
и 
Пример. Рассчитать и построить кривую титрования 100мл 0.1000 М раствора аммиака 0.1000 М раствором соляной кислоты. В таблице 4.8 приведены результаты расчета, а на рис.4.8 – кривая титрования.
Табл. Значения рН при титровании 100мл 0.1000 М р-ра аммиака 0.1000 М р-ром соляной кислоты
| τ,% | Состав раствора, % | Компоненты определяющие рН | Формула расчета 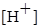 , , 
| рН | |||
| 
| ||||||
| 100.0 | ─ | 
| 
| 11.12 | |||
| 50.0 | 50.0 | 50.0 | 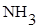 и и 
| 
| 9.25 | ||
| 90.0 | 10.0 | 90.0 | То же | То же | 8.29 | ||
| 99.0 | 1.0 | 99.0 | То же | То же | 7.25 | ||
| 99.9 | 0.1 | 99.9 | То же | То же | 6.25 | ||
| 100.0 | ─ | 100.0 | 
| 
| 5.27 | ||
| 100.1 | ─ | 100.0+ 0.1 HCl | HCl | 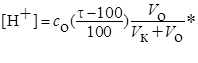
| 4.30 | ||
| 101.0 | ─ | 100.0+ 1.0 HCl | То же | То же | 3.30 | ||
| 110.0 | ─ | 100.0+ 10.0 HCl | То же | То же | 2.32 | ||
*Примечание: можно: 

Рис. 4.8. Кривая титрования 0.1000 М NH3 раствором 0.1000 М HCI.
В общем виде связь между константой оснóвности титруемого основания и величиной скачка титрования представлена на рис.4.9

Рис. 4.9. Связь между константой оснóвности титруемого основания и
величиной скачка титрования. Каждая кривая соответствует титрованию 0.1 М раствора основания 0.1 М раствором HCI.