ХРОМОТОГРАФИЯ
Хроматография — это физико-хими- ческий метод разделения веществ, основанный на распределении компонентов между двумя фазами — неподвижной и подвижной. Неподвижной (стационарной) фазой обычно служит твердое вещество (его часто называют сорбентом) или пленка жидкости, нанесенная на твердое вещество. Подвижная фаза представляет собой жидкость или газ, протекающий через неподвижную фазу.
Компоненты анализируемой смеси вместе с подвижной фазой передвигаются вдоль стационарной фазы. Последнюю обычно помещают в стеклянную (или металлическую) трубку, называемую колонкой. В зависимости от силы взаимодействия с поверхностью сорбента (за счет адсорбции или по какому-либо еще механизму) компоненты перемещаются вдоль колонки с разной скоростью. Одни компоненты остаются в верхнем слое сорбента, другие, с меньшей степенью взаимодействия с сорбентом, оказываются в нижней части колонки, некоторые покидают колонку вместе с подвижной фазой. Таким образом компоненты разделяются.
Метод позволяет разделять многокомпонентную смесь, идентифицировать компоненты и определять ее количественный состав.
Классификация хроматографических методов
В основу общепринятых классификаций многочисленных хроматографических методов положены следующие признаки: агрегатное состояние подвижной и неподвижной фаз, механизм взаимодействия сорбент—сорбат, форма слоя сорбента (техника выполнения), цель хроматографирования.
По агрегатному состоянию фаз хроматографию разделяют на газовую, жидкостную и сверхкритическую флюидную. Газовая хроматография включает газожидкостную и газотвердофазную, жидкостная — жидкостно-жидкостную, жидкостно-твердофазную и жидкостно-гелевую. Известна флюидно-жидкостная хроматография. Первое слово в названии метода характеризует агрегатное состояние подвижной фазы, второе — неподвижной.
По механизму взаимодействия сорбента и сорбата можно выделить несколько видов хроматографии: распределительная хроматография основана на различии в растворимости разделяемых веществ в неподвижной фазе (газожидкостная хроматография) или на различии в растворимости веществ в подвижной и неподвижной жидких фазах; ионообменная хроматография — на разной способности веществ к ионному обмену; адсорбционная хроматография — на различии в адсорбируемости веществ твердым сорбентом; эксклюзионная хроматография — на различии в размерах и формах молекул разделяемых веществ, аффинная хроматография — на специфических взаимодействиях, характерных для некоторых биологических и биохимических процессов.
По технике выполнения выделяют колоночную хроматографию, когда разделение проводится в специальных колонках, и плоскостную хроматографию, когда разделение проводится на специальной бумаге (бумажная хроматография) или в тонком слое сорбента (тонкослойная хроматография).
Подвижную фазу, вводимую в слой неподвижной фазы, называют элю- ентом, а подвижную фазу, выходящую из колонки и содержащую разделенные компоненты, — элюатом. В элюате тем или иным способом определяют содержание компонентов. Распределение разделяемых веществ в виде отдельных полос (зон) вдоль колонки представляет собой внутреннюю хроматограмму (рис. 8.2). Графическое изображение (часто получаемое с помощью самописца) распределения веществ в элюате называют внешней хроматограммой, или просто хроматограммой.
По способу получения хроматограмм различают элюентную, вытеснительную и фронтальную хроматографии.
Элюентная (проявителъная) хроматография. Хроматографическую колонку промывают элюентом (раствором или растворителем), обладающим меньшей сорбируемостью, чем любое из разделяемых веществ. Затем в колонку вводят разделяемые вещества, растворенные в элюенте, и продолжают непрерывно пропускать элюент (процесс элюирования). При этом разделяемые вещества перемещаются вдоль колонки с разными скоростями, например, в соответствии с их сорбируемостью. Если скорости перемещения компонентов достаточно различаются, то на выходе из колонки сначала появляется наименее сорбируемый компонент, затем следующий компонент и т. д. В этом случае хроматограмма представляет собой несколько пиков, имеющих форму гауссовой кривой.
Хроматографические параметры
 На рис. 8.3 представлена идеализированная хроматограмма смеси двух веществ. По оси абсцисс отложено время хроматографирования (можно отложить объем элюата), по оси ординат — аналитический сигнал, зависящий от концентрации веществ в элюате (отклик А). Рассмотрим основные хроматографические параметры, характеризующие поведение вещества в колонке. Время от момента ввода анализируемой пробы до регистрации максимума пика называют временем удерживания (элюирования) tR. Время удерживания складывается из двух составляющих — времени пребывания вещества в подвижной tm и неподвижной ts фазах:
На рис. 8.3 представлена идеализированная хроматограмма смеси двух веществ. По оси абсцисс отложено время хроматографирования (можно отложить объем элюата), по оси ординат — аналитический сигнал, зависящий от концентрации веществ в элюате (отклик А). Рассмотрим основные хроматографические параметры, характеризующие поведение вещества в колонке. Время от момента ввода анализируемой пробы до регистрации максимума пика называют временем удерживания (элюирования) tR. Время удерживания складывается из двух составляющих — времени пребывания вещества в подвижной tm и неподвижной ts фазах:
Значение tm фактически равно времени прохождения через колонку не-
сорбируемого компонента. Значение tR не зависит от количества пробы, но
зависит от природы вещества и сорбента, а также упаковки сорбента и может меняться от колонки к колонке. Поэтому для характеристики истиной удерживающей способности следует ввести исправленное время удерживания t'R:

Для характеристики удерживания часто используют понятие удерживаемого объема VR — объем подвижной фазы, который нужно пропустить через колонку с определенной скоростью, чтобы элюировать вещество:
где/7— объемная скорость потока, см3•с-1.
Объем для вымывания несорбируемого компонента, мертвый объем, выражается через tm: Vm = tmF, и включает в себя объем колонки, не занятый сорбентом, объем коммуникаций от устройства ввода пробы до колонки и от колонки до детектора. Исправленный удерживаемый объем соответственно равен

При постоянных условиях хроматографирования (скорость потока, давление, температура, состав фаз) значения tR и VR строго воспроизводимы и могут быть использованы для идентификации веществ.
Количество вещества, вымываемого из колонки, можно найти по площади под кривой элюирования:
т= jcdV
о
где с — концентрация, ммоль/мл; V— объем, мл.
Полезным параметром в хроматографии может быть коэффициент удерживания (замедления) R — отношение скорости движения вещества к скорости движения подвижной фазы:.
Для неудерживаемого вещества tR - tm и R =1. Если время пребывания в подвижной и неподвижной фазах одинаково (tm = ts), то R = 0,5. Очевидно, что R можно выразить через VR:
 (8.6)
(8.6)
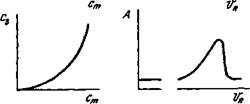
 Любой процесс распределения вещества между двумя фазами характеризуют коэффициентом распределения D (см. гл. 7). В данном случае D = cs/cm, где ст и cs — концентрации вещества в подвижной и неподвижной фазах соответственно. Коэффициент распределения связан с хроматографическими параметрами. Действительно, отношение времени пребывания вещества в неподвижной и подвижной фазах равно отношению количеств вещества в фазах cV:
Любой процесс распределения вещества между двумя фазами характеризуют коэффициентом распределения D (см. гл. 7). В данном случае D = cs/cm, где ст и cs — концентрации вещества в подвижной и неподвижной фазах соответственно. Коэффициент распределения связан с хроматографическими параметрами. Действительно, отношение времени пребывания вещества в неподвижной и подвижной фазах равно отношению количеств вещества в фазах cV:
При хроматографировании одновременно происходит разделение веществ и размывание хроматографических пиков разделяемых веществ, приводящее к ухудшению разделения. Остановимся на теоретических подходах, объясняющих эти два противоположных процесса хроматографии. Теория хроматографии призвана выявить причины размывания пиков и прогнозировать эффективность разделения смеси веществ.
| D = dcs/dcm. |

 Хроматографическое разделение определяется различной сорбцией компонентов смеси, что связано с природой сорбента и разделяемых веществ. На основании сведений по термодинамике сорбции (адсорбции, растворения или ионного обмена) можно судить о возможности разделения смеси веществ. Теоретический подход, объясняющий размывание, основан на изучении форм изотерм сорбции — графической зависимости количества вещества в неподвижной фазе cs от его концентрации в подвижной фазе ст при постоянной температуре. Изотерма может быть линейной (а), выпуклой (б) или вогнутой (в) (рис. 8.4). Угол наклона изотермы определяется коэффициентом распределения
Хроматографическое разделение определяется различной сорбцией компонентов смеси, что связано с природой сорбента и разделяемых веществ. На основании сведений по термодинамике сорбции (адсорбции, растворения или ионного обмена) можно судить о возможности разделения смеси веществ. Теоретический подход, объясняющий размывание, основан на изучении форм изотерм сорбции — графической зависимости количества вещества в неподвижной фазе cs от его концентрации в подвижной фазе ст при постоянной температуре. Изотерма может быть линейной (а), выпуклой (б) или вогнутой (в) (рис. 8.4). Угол наклона изотермы определяется коэффициентом распределения
| D = dcs/dcm. |


Теория теоретических тарело к
Теория теоретических тарелок, общая для всех многостадийных процессов (например, противоточной экстракции), впервые была предложена для описания процесса дистилляции, Мартин и Синдж распространили ее на хроматографические системы. Теория основана на некоторых допущениях:
колонка состоит из определенного числа теоретических ступеней (тарелок); 2) равновесие на каждой тарелке считается достигнутым до того, как подвижная фаза переместится на следующую тарелку, т. е. равновесие устанавливается мгновенно; 3) на любой тарелке в любой момент времени число молекул (ионов) сорбируемых компонентов пробы значительно меньше, чем число сорбируемых молекул (ионов) элюента, т. е. вводимая проба должна быть малой, а изотерма — линейной; 4) все протекающие в колонке процессы рассматриваются как взаимно независимые.
Теоретическая тарелка —
это гипотетическая зона, высота которой соответствует достижению равновесия между двумя фазами. Чем больше теоретических тарелок в колонке, т. е. чем большее число раз устанавливается равновесие, тем эффективнее колонна. Эффективность колонки — это характеристика качества колонки, определяемая числом теоретических тарелок и высотой теоретической тарелки. Так как хроматографический процесс непрерывен и неравновесен, то представление о теоретической тарелке в хроматографии имеет умозрительный, формальный характер. Эта теория позволяет описать движение зоны с максимальной концентрацией компонента, экспериментально оценить ширину полосы (степень размывания хроматографической полосы) и эффективность колонки.
Количественной мерой эффективности хроматографической колонки служат высота Н, эквивалентная теоретической тарелке (ВЭТТ), и число теоретических тарелок N.
Теория теоретических тарелок дает возможность сравнить эффективность различных колонок, оценить качество сорбента и заполнения колонки. Однако эта теория не позволяет выявить зависимость N и Н от скорости подвижной фазы, природы и зернения сорбента, не может дать практических рекомендаций, позволяющих избежать размывания хроматографических пиков.
Схема хроматографа
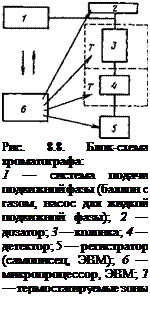 Хроматографическое разделение осуществляют в приборах — хроматографах, блок- схема хроматографа приведена на рис. 8.8. В современных хроматографах широко применяют микропроцессоры и ЭВМ. Основной узел хроматографа — колонка. Колонки бывают металлические, стеклянные и пластиковые. Количество вещества, выходящего из колонки, регистрируют с помощью детектора, сигналы которого записывают в виде хроматограмм.
Хроматографическое разделение осуществляют в приборах — хроматографах, блок- схема хроматографа приведена на рис. 8.8. В современных хроматографах широко применяют микропроцессоры и ЭВМ. Основной узел хроматографа — колонка. Колонки бывают металлические, стеклянные и пластиковые. Количество вещества, выходящего из колонки, регистрируют с помощью детектора, сигналы которого записывают в виде хроматограмм.
Современный хроматограф может включать несколько колонок и различные детекторы, а также автоматическое устройство для подготовки и ввода пробы. Подсоединенный к хроматографу компьютер, имеющий запоминающее устройство и банк хроматографических данных, обеспечивает аналитика богатой информацией.
Быстрое внедрение запоминающих устройств и мощных процессоров в хроматографическую технику дает возможность значительно усовершенствовать идентификацию и количественную обработку хроматографических пнков. Для этого необходима строгая слаженность работы всей хроматографической схемы: от ввода пробы, правильного заполнения колонки, разумного выбора подвижной фазы и детектора. Кроме того, необходима автоматизация всего хроматографического процесса, которая устраняет субъективные ошибки, увеличивает скорость обработки результатов.
Селективность и разрешение
 Хроматографическое разделение основано на селективности сорбента и различии в термодинамических свойствах хроматографируемых веществ в системе сорбент—элюент. Для решения вопроса о возможности хроматографического разделения смеси на индивидуальные вещества нужно сопоставить их хроматографические параметры. Для этого используют коэффициент селективности а и разрешение Rs. Коэффициент селективности является мерой относительного удерживания или относительной подвижности разделяемых веществ:
Хроматографическое разделение основано на селективности сорбента и различии в термодинамических свойствах хроматографируемых веществ в системе сорбент—элюент. Для решения вопроса о возможности хроматографического разделения смеси на индивидуальные вещества нужно сопоставить их хроматографические параметры. Для этого используют коэффициент селективности а и разрешение Rs. Коэффициент селективности является мерой относительного удерживания или относительной подвижности разделяемых веществ:
Это термодинамическая характеристика, зависящая при постоянной температуре только от природы разделяемых соединений и свойств подвижной и неподвижной фаз.
При а = 1 разделение соединений в данных условиях невозможно. Только вещества с разными D будут перемещаться вдоль колонки с разными скоростями, что и приводит к их хроматографическому разделению.