Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
Ряд увеличения основных свойств аминов:
| C6H5-NH2 < NH3 < R3N < R-NH2 < R2NH -------------------------------------------------→ возрастание основных свойств |
В растворах оснoвные свойства третичных аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три радикала создают пространственные препятствия для сольватации образующихся аммониевых ионов. По этой же причине основность первичных и вторичных аминов снижается с увеличением размеров и разветвленности радикалов.
Водные растворы аминов имеют щелочную реакцию (амины реагируют с водой по донорно-акцепторному механизму):
R-NH2 + H2O → [R-NH3]+ + OH-
ион алкиламмония
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
Изучение среды раствора анилина
1. Взаимодействие с кислотами (донорно-акцепторный механизм):
CH3-NH2 + H2SO4 → [CH3-NH3]HSO4
(соль - гидросульфат метиламмония)
2CH3-NH2 + H2SO4 → [CH3-NH3]2SO4
(соль - сульфат метиламмония)
2. Соли неустойчивы, разлагаются щелочами:
[CH3-NH3]2SO4 + 2NaOH → 2CH3-NH2 ↑ + Na2SO4 + H2O
Способность к образованию растворимых солей с последующим их разложением под действием оснований часто используют для выделения и очистки аминов, не растворимых в воде. Например, анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном состоянии.
3. Реакции окисления.
Реакция горения (полного окисления) аминов на примере метиламина:
4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
Ароматические амины легко окисляются даже кислородом воздуха. Являясь в чистом виде бесцветными веществами, на воздухе они темнеют. Неполное окисление ароматических аминов используется в производстве красителей. Эти реакции обычно очень сложны.
Особые свойства анилина.
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
1). Для анилина характерны свойства бензольного кольца – действие аминогруппы на бензольное кольцо приводит к увеличению подвижности водорода в кольце в орто- и пара- положениях:
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Эта реакция может использоваться для качественного и количественного определения анилина: бромирование анилина
2). Свойства аминогруппы:
С6Н5NН2 + HCl → [С6Н5NН3 ]+Сl-
хлорид фениламмония
Получение анилина из нитробензола.
Получение анилина из нитробензола.
Из-за запаха низшие амины долгое время принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на воздухе с образованием углекислого газа. Он же синтезировал метиламин и этиламин.
Г Н. Н. Зинин получил анилин восстановлением нитробензола - в промышленности
Восстановление нитросоединений:
R-NO2 + 6[H] t,kat-Ni → R-NH2 + 2H2O
или
R-NO2+3(NH4)2S t, Fe в кислой среде →R-NH2 +3S↓ +6NH3↑ + 2H2O (р. Зинина)
Другие способы:
1). Алкилирование аммиака осуществляют нагреванием галогеноалканов с аммиаком под давлением. (Промышленный способ).
CH3Cl + 2NH3 t, ↑p → CH3-NH2 + NH4Cl
2). Лабораторный - Действие щелочей на соли алкиламмония
(получение первичных, вторичных, третичных аминов):
[R-NH3]Г + NaOH t → R-NH2 + NaГ + H2O
3).Пропусканием паров спирта и аммиака при 300оС над катализатором.
С2Н5ОН + NН3 С2Н5-NН2 +Н2О
Применение анилина на основе свойств.
Амины используют при получении лекарственных веществ, красителей и исходных продуктов для органического синтеза. Гексаметилендиамин при поликонденсации с адипиновой кислотой дает полиамидные волокна.
Анилин находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
Вопросы для самоконтроля
· Написать электронное строение азота и водорода.
· Написать электронную и структурную формулу аммиака.
· Что такое углеводородный радикал?
· Какие вы знаете углеводородные радикалы?
· Замените в молекуле аммиака один водород на метильный радикал.
· Как вы считаете, что это за соединение и как оно называется?
· Какое вещество получится, если заменить остальные атомы водорода на углеводородные радикалы, например, метильные?
· Как изменятся свойства полученных соединений?
· Определите формулу органического вещества, если известно, что плотность его паров по водороду равна 22,5, массовая доля углерода – 0,533,массовая доля водорода – 0,156 и массовая доля азота – 0,311. (Ответ: С2Н7N.)
· Учебник Г.Е.Рудзитис, Ф.Г.Фельдман. Страница 173, № 6, 7.
ПЛАН ЗАНЯТИЯ № 18
Дисциплина: Химия.
Тема: Аминокислоты.
Цель занятия: Рассмотреть аминокислоты как амфотерные дифункциональные органические соединения. Химические свойства аминокислот: взаимодействие со щелочами, кислотами и друг с другом (реакция поликонденсации). Пептидная связь и полипептиды. Применение аминокислот на основе свойств.
Планируемые результаты
Предметные: сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач; сформированность собственной позиции по отношению к химической информации, получаемой из разных источников;
Метапредметные: использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи;
Личностные: умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
Норма времени: 2 часа
Вид занятия: Лекция.
План занятия:
1. Аминокислоты как амфотерные дифункциональные органические соединения.
2. Химические свойства аминокислот: взаимодействие со щелочами, кислотами и друг с другом (реакция поликонденсации).
3. Пептидная связь и полипептиды.
4. Применение аминокислот на основе свойств.
Оснащение: Учебник.
Литература:
1. Химия 10 класс: учеб. для общеобразоват. организаций с прил. на электрон. Носителе (DVD) / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил.
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.
Тема 18. Аминокислоты.
План:
1. Аминокислоты как амфотерные дифункциональные органические соединения.
2. Химические свойства аминокислот: взаимодействие со щелочами, кислотами и друг с другом (реакция поликонденсации).
3. Пептидная связь и полипептиды.
4. Применение аминокислот на основе свойств.
1) Аминокислоты как амфотерные дифункциональные органические соединения.
Аминокислоты – это органические соединения, которые содержат две функциональные группы: аминогруппу – NH2 и карбоксильную группу – COOH, связанные с углеводородным радикалом.
Строение первого представителя данного класса – аминоуксусной кислоты
СН2 – С = О
| |
NH2 ОН
Изомерия и номенклатура:
Правила тривиальной и систематической номенклатуры
Исторические названия незаменимых аминокислот
-Какие виды изомерии характерны для этих соединений?
1. изомерия углеводородного скелета
2. изомерия положения функциональной группы
3. оптическая изомерия
Оптически активные вещества встречаются в виде пар антиподов-изомеров, физические и химические свойства которых одинаковы, за исключением одного – способности вращать плоскость поляризованного луча в противоположные стороны.
 Различают D-аминокислоты и L-аминокислоты.
Различают D-аминокислоты и L-аминокислоты.
Физические и химические свойства оптических изомеров практически идентичны, эти вещества могут существенно отличаться по своей биологической активности, совместимости с другими природными соединениями, даже по вкусу и запах.
Классификация аминокислот.
Аминокислоты делят на:
• Природные
Их около 150, они были обнаружены в живых организмах, около 20 из них входят в состав белков. Половина этих аминокислот – незаменимые (не синтезируются в организме человека), поступают с пищей.
• Синтетические
Получают кислотным гидролизом белков, либо из карбоновых кислот, воздействуя на них галогеном, а затем аммиаком.
2) Химические свойства аминокислот: взаимодействие со щелочами, кислотами и друг с другом (реакция поликонденсации).
1) Образование солей это амфотерные соединения, поэтому они способны образовывать соли как с кислотами, так и с основаниями.-. Аминокислоты

-Аминокислоты способны также образовывать устойчивые комплексные соли с ионами некоторых двухвалентных металлов: Cua2+, Ni2+, Zn2+, Co2+. С ионами Cu2+ получаются кристаллические хелатные соли синего цвета, которые используются для выявления, выделения и очистки аминокислот (качественная реакция).

2) Реакции по карбоксильной группе

3) Реакции по аминогруппе

4) Реакции аминокислот под действием ферментов
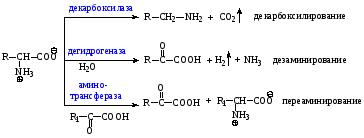
5. Аминокислоты взаимодействуют друг с другом
NH2 –CH2 –COOH + NH2 –CH2 –COOH → NH2 –CH2 –CO-NH–CH2 –COOH + Н2О
дипептид
-СО–NH – пептидная группа (амидная группа)
3) Пептидная связь и полипептиды.
α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Карбоксильная группа одной аминокислоты ковалентно связывается с аминогруппой другой аминокислоты. При этом возникает R- CO-NH -R связь, называемая пептидной связью. При этом происходит отщепление молекулы воды.
 При помощи пептидных связей из аминокислот образуются белки и пептиды. Пептиды, содержащие до 10 аминокислот, называют олигопептиды. Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, октапептид и т.д. Пептиды, содержащие более 10 аминокислот, называют «полипептиды», а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Мономеры аминокислот, входящих в состав белков, называют «аминокислотные остатки». Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную C-карбоксильную группу — С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца.
При помощи пептидных связей из аминокислот образуются белки и пептиды. Пептиды, содержащие до 10 аминокислот, называют олигопептиды. Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, октапептид и т.д. Пептиды, содержащие более 10 аминокислот, называют «полипептиды», а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Мономеры аминокислот, входящих в состав белков, называют «аминокислотные остатки». Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную C-карбоксильную группу — С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца.
Связь между α-углеродным атомом и α-аминогруппой или α-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации, т.е. α-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве. Пептидные связи очень прочны и являются ковалентными.
В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью. Такими являются целый ряд гормонов – окситоцин (9 аминокислотных остатков), вазопрессин (9), брадикинин (9) регулирующий тонус сосудов, тиреолиберин (3), антибиотики – грамицидин, пептиды, обладающие обезболивающим действием (энкефалины(5) и эндорфины и другие опиоидные пептиды). Обезболивающий эффект этих пептидов в сотни раз превосходит анальгезирующий эффект морфина;
4) Применение аминокислот на основе свойств.
Аминокислоты, преимущественно α-аминокислоты, необходимы для синтеза белков в живых организмах. Нужные для этого аминокислоты человек и животные получают в виде пищи, содержащей различные белки. Последние подвергаются в пищеварительном тракте расщеплению на отдельные аминокислоты, из которых затем синтезируются белки, свойственные данному организму. Некоторые аминокислоты применяются в медицинских целях. Многие аминокислоты служат для подкормки животных.
Производные аминокислот используются для синтеза волокна, например капрона.
Вопросы для самоконтроля
ü Что такое кислота?
ü Что такое функциональная группа?
ü Какие вы помните функциональные группы?
ü Что такое аминогруппа?
ü Какими свойствами обладает аминогруппа?
ü Какими свойствами обладает кислота?
ü Как вы считаете, какую реакцию среды будет давать молекула, содержащая кислотную и основную группу?
ü ТЕСТ
ü 1 вариант.
ü 1) В состав аминокислот входят функциональные группы:
ü а) -NH2 и –ОН
ü б) -NH2 и –СОН
ü в) -NH2 и –СООН
ü г) -ОH и –СООН
ü 2. Аминокислоты можно рассматривать как производные:
ü а) алкенов;
ü б) спиртов;
ü в) карбоновых кислот;
ü г) углеводов.
ü 3. Аминокислоты вступают в реакцию
ü а) полимеризацию;
ü б) поликондесацию;
ü в) нейтрализацию.
ü 4.Связь между аминокислотами в полимере:
ü а) водородная;
ü б) ионная;
ü в) пептидная.
ü 5. Незаменимые аминокислоты - это …
ü 2 вариант.
ü 1.Общая формула аминокислот:
ü а)R-СН2 (NH2)-СООН;
ü б) R-СООН;
ü в) R-СОН;
ü г) R-ОН.
ü 2. В растворе аминокислот среда
ü а) щелочная;
ü б) нейтральная;
ü в) кислотная.
ü 3. Аминокислоты могут взаимодействовать друг с другом при этом образуя:
ü а) углеводы;
ü б) нуклеиновые кислоты;
ü в) полипептиды;
ü г)крахмал.
ü 4. Аминокислоты – это...
ü а) органические основания;
ü б) кислоты
ü в) органические амфотерные соединения.
ü 5. Аминокислоты применяют в …
ü Из каких неорганических веществ можно получить аминоуксусную кислоту? Напишите соответствующие уравнения реакций.
ü Задача. Определите формулу аминокислоты, если массовые доли углерода, водорода, кислорода и азота соответственно равны: 48%, 9,34%, 42,67% и 18, 67%. Напишите все возможные структурные формулы и назовите их
ПЛАН ЗАНЯТИЯ № 19
Дисциплина: Химия.
Тема: Белки.
Цель занятия: Изучить первичную, вторичную, третичную структуры белков. Химические свойства белков: горение, денатурация, гидролиз, цветные реакции. Биологические функции белков.
Планируемые результаты
Предметные: сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
Метапредметные: использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи;
Личностные: чувство гордости и уважения к истории и достижениям отечественной химической науки; химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
Норма времени: 2 часа
Вид занятия: Лекция.
План занятия:
1. Белки. Первичная, вторичная, третичная структуры белков.
2. Химические свойства белков: горение, денатурация, гидролиз, цветные реакции.
3. Биологические функции белков.
Оснащение: Учебник.
Литература:
1. Химия 10 класс: учеб. для общеобразоват. организаций с прил. на электрон. Носителе (DVD) / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил.
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.
Тема 19. Белки.
План:
1. Белки. Первичная, вторичная, третичная структуры белков.
2. Химические свойства белков: горение, денатурация, гидролиз, цветные реакции.
3. Биологические функции белков.
1) Белки. Первичная, вторичная, третичная структуры белков.
1 – Состав белка: С – 54%, О – 23%, Н – 7%, N – 17%, S – 2% и другие: Zn, P, Fe, Cu, Mg, Mn
В 1903 г. немецкий ученый Э.Г.Фишер предложил пептидную теорию, которая стала ключом к тайне строения белка. Фишер предположил, что белки представляют собой полимеры из остатков аминокислот, соединенных пептидной связью NH–CO. Идея о том, что белки – это полимерные образования, высказывалась еще в 1888 г. русским ученым А.Я.Данилевским.
 2 - Белки – ВМС – протеины
2 - Белки – ВМС – протеины
“Протос” от греческого – “первичный, важнейший”. Белки – природные полимеры, состоящие из АК.
Mr (альбумина)=36000
Mr (миозина)=150000
Mr (гемоглобина)=68000
Mr (коллагена)=350000
Mr (фибриногена)=450000
Формула белка молока – казеина C1894H3021O576N468S21
Белки – это природные высокомолекулярные природные соединения (биополимеры), построенные из альфа-аминокислот, соединенных особой пептидной связью. В состав белков входит 20 различных аминокислот, отсюда следует огромное многообразие белков при различных комбинациях аминокислот. Как из 33 букв алфавита мы можем составить бесконечное число слов, так из 20 аминокислот – бесконечное множество белков. В организме человека насчитывается до 100 000 белков.
Число аминокислотных остатков, входящих в молекулы, различно: инсулин – 51, миоглобин – 140. Отсюда M r белка от 10 000 до нескольких миллионов.
Белки подразделяют на протеины (простые белки) и протеиды (сложные белки).
3 -

4 - 20 АК – “кирпичики” белкового здания, соединяя их в разном порядке, можно выстроить неисчислимое множество веществ с самыми разными свойствами. Химики пытаются расшифровать строение белковых молекул-великанов. Задача эта очень трудная: природа тщательно прячет “чертежи”, по которым выстроены эти частицы.
В 1888 году русский биохимик А.Я. Данилевский указал на то, что в молекулах белков содержатся повторяющиеся пептидные группы атомов –С–N–
В начале ХХ столетия немецкому ученому Э.Фишеру и другим исследователям удалось синтезировать соединения, в молекулы, которых входило 18 остатков различных АК, соединенных пептидными связями.

 5 - Первичная структура белка – это последовательное чередование АК (полипептидная цепь ППЦ). Пространственная конфигурация белковой молекулы, напоминающая спираль образуется благодаря многочисленным водородным связям между группами.
5 - Первичная структура белка – это последовательное чередование АК (полипептидная цепь ППЦ). Пространственная конфигурация белковой молекулы, напоминающая спираль образуется благодаря многочисленным водородным связям между группами.
– СО– и –NH–
Такая структура белка называется вторичной. В пространстве закрученная спираль ППЦ образует третичную структуру белка, которая поддерживается взаимодействием разных функциональных групп ППЦ.
–S–S– (дисульфидный мостик)
–СООН и –ОН (сложноэфирный мостик)
–СООН и –NH2 (солевой мостик)
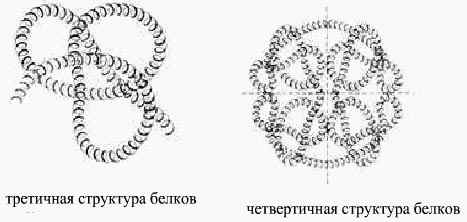 Некоторые белковые макромолекулами могут соединяться друг с другом и образовывать крупные молекулы. Полимерные образования белков называются четвертичными структурами (гемоглобин только при такой структуре способен присоединять и транспортировать О2 в организм)
Некоторые белковые макромолекулами могут соединяться друг с другом и образовывать крупные молекулы. Полимерные образования белков называются четвертичными структурами (гемоглобин только при такой структуре способен присоединять и транспортировать О2 в организм)
2) Химические свойства белков: горение, денатурация, гидролиз, цветные реакции.
1. Для белков характерны реакции, в результате которых выпадает осадок. Но в одних случаях полученный осадок при избытке воды растворяется, а в других – происходит необратимое свертывание белков, т.е. денатурация.
Денатурация – это изменение третичной и четвертичной структур белковой макромолекулы под влиянием внешних факторов (повышение или понижение температуры, давления, механического воздействия, действия химических реагентов, УФ – излучения, радиации, ядов, солей тяжелых металлов (свинец, ртуть и др.))