Тема 6 Электронные конфигурации атомов химических элементов.
План:
1. Понятие об орбиталях. s -, р - и d -орбитали.
2. Электронные конфигурации атомов химических элементов.
Понятие об орбиталях. s-, р- и d-орбитали
Атом – это электронейтральная частица, которая состоит из положительно заряженного ядра и отрицательно заряженных электронов.
Электроны располагаются вокруг ядра на энергетических уровнях, количество которых равно номеру периода.
Атомная орбиталь – это геометрический образ, отвечающий объему пространства вокруг атомного ядра, который соответствует 90 %-ой вероятности нахождения в этом объеме электрона (как частицы) и одновременно 90 %-ой плотности заряда электрона (как волны).
Внимательное рассмотрение атомных спектров показывает, что «толстые» линии, обусловленные переходами между энергетическими уровнями, на самом деле расщеплены на более тонкие линии. Это означает, что электронные оболочки в действительности расщеплены на подоболочки. Электронные подоболочки обозначают по типам соответствующих им линий в атомных спектрах:
s -подоболочка названа по «резкой» s -линии – sharp;
p -подоболочка названа по «главной» p -линии – principal;
d -подоболочка названа по «диффузной» d -линии – diffuse;
f -подоболочка названа по «фундаментальной» f -линии – fundamental.

Энергетические уровни, подуровни и орбитали многоэлектронного атома
| Энерге-тический уровень n | Энергетический подуровень | Обозначение орбитали | Число орби-
талей
n 
| Число электронов
2n 
| |
| l | вид орбитали | ||||
| s | 1s | ||||
| s p | 2s 2p | 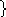 1
3 4 1
3 4
| 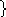 2 8 2 8
| ||
| s p d | 3s 3p 3d |  1
3 9 1
3 9
|  2
6 18 2
6 18
| ||
| s p d f | 4s 4p 4d 4f |  1
3 16 1
3 16
|  2
6 32 2
6 32
|
Принцип Паули: в атоме не могут находится два электрона в тождественных состояниях.
В соответствии с принципом Паули можно утверждать, что каждый электрон в атоме однозначно характеризуется своим набором четырех квантовых чисел – главного n, орбитального l, магнитного m и спинового s.
Заселение электронами энергетических уровней, подуровней и атомных орбиталей подчиняется следующему правилу (принцип минимума энергии): в невозбужденном состоянии все электроны обладают наименьшей энергией.
Это означает, что каждый из электронов, заполняющих оболочку атома, занимает такую орбиталь, чтобы атом в целом имел минимальную энергию. Последовательное квантовое возрастание энергии подуровней происходит в следующем порядке:
1 s – 2 s – 2 p – 3 s – 3 p – 4 s – 3 d – 4 p – 5 s - …..
Заполнение атомных орбиталей внутри одного энергетического подуровня происходит в соответствии с правилом, сформулированным немецким физиком Ф.Хундом (1927 г.).
Правило Хунда: атомные орбитали, принадлежащие к одному подуровню, заполняются каждая вначале одним электроном, а затем происходит их заполнение вторыми электронами.
Правило Хунда также называют принципом максимальной мультиплетности, т.е. максимально возможного параллельного направления спинов электронов одного энергетического подуровня.
На высшем энергетическом уровне свободного атома может находиться не более восьми электронов.
Электроны, находящиеся на высшем энергетическом уровне атома (во внешнем электронном слое), называются внешними; число внешних электронов у атома любого элемента никогда не бывает больше восьми. Для многих элементов именно число внешних электронов (при заполненных внутренних подуровнях) в значительной степени определяет их химические свойства. Для других электронов, у атомов которых есть незаполненный внутренний подуровень, например 3 d- подуровень у атомов таких элементов, как Sc, Ti, Cr, Mn и др., химические свойства зависят от числа как внутренних, так и внешних электронов. Все эти электроны называются валентными; в сокращенных электронных формулах атомов они записываются после условного обозначения атомного остова, т. е. после выражения в квадратных скобках.
Обычно ē стремятся занять наиболее близкое к ядру положение, соответствующее меньшему запасу энергии: сначала заполняются s-орбиталь, потом р-орбиталь. ē занимают d- и f-орбитали лишь тогда, когда s- и р-орбитали уже заполнены.
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d1 =4f14 < 5d10 <6p < 7s < 6d1 = 5f14 < 6d10 < 7p.