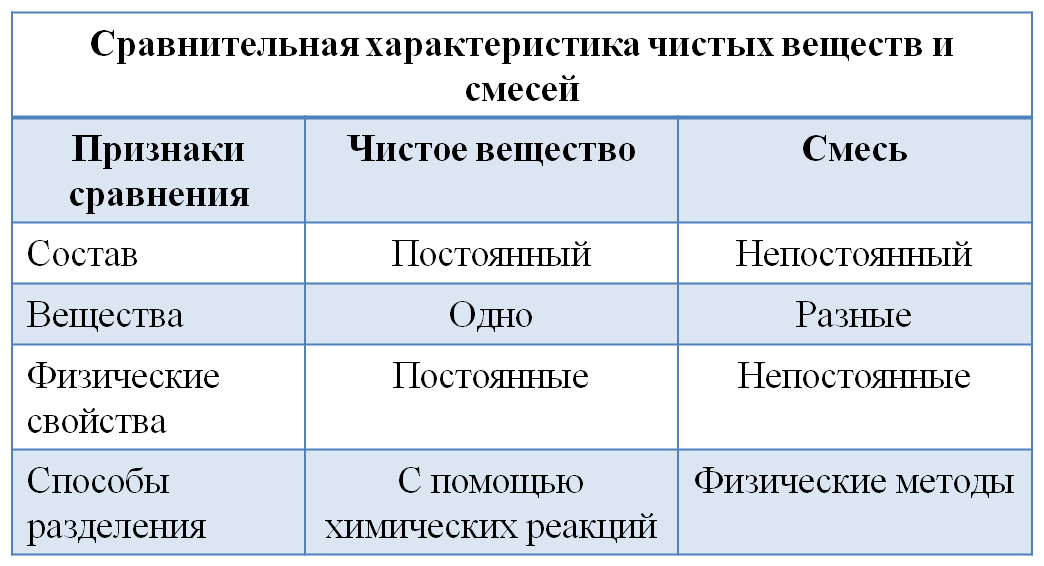
Чистое вещество имеет определенный постоянный состав или структуру (соль, сахар).
 В жизни редко встречаются чистые вещества, чаще - смеси веществ. Воздух – это смесь азота, кислорода и других газов, морская вода – смесь воды и растворенных солей.
В жизни редко встречаются чистые вещества, чаще - смеси веществ. Воздух – это смесь азота, кислорода и других газов, морская вода – смесь воды и растворенных солей.
Смеси - это физические сочетания чистых веществ, не имеющие определенного или чистого состава.
Примером смеси может служить обыкновенный чай (напиток), который многие самостоятельно готовят и пьют по утрам.
Кто-то любит крепкий чай (большое кол-во заварки), кто-то любит сладкий чай (большое кол-во сахара)… Как видим, смесь под названием "чай" всегда получается немного разной, хотя и состоит из одних и тех же компонентов. Однако, следует отметить, что каждый компонент смеси сохраняет набор своих характеристик, поэтому, разные вещества можно выделить из смеси.
Гомогенные и гетерогенные смеси.
 Гетерогенные смесиполностью не смешаны, так как чистые вещества существуют в ясно отграниченных фазах, то есть это многофазные материалы.
Гетерогенные смесиполностью не смешаны, так как чистые вещества существуют в ясно отграниченных фазах, то есть это многофазные материалы.
Гомогенные смеси — это на молекулярном уровне смешанные чистые вещества, то есть однофазные материалы.
Гомогенные смеси делятся по агрегатному состоянию на три группы:
- газовые смеси;
- растворы;
- твёрдые растворы.
Гетерогенные смеси двух веществ можно разделить по агрегатным состояниям на следующие группы:
| Твёрдые частички | Капли жидкости | Пузырьки газа | |
| В твердом теле | Сплав | Капиллярная система | Твёрдая пена, порошок |
| В жидкости | Суспензия | Эмульсия | Пена |
| В газе | Аэрозоль | Туман | Неустойчиво |
Основные способы разделения смеси
Существуют различные методы разделения смесей. Для газов эти методы основаны на разнице в скоростях либо массах молекул веществ, входящих в смесь.
1. Основные способы выделения веществ из неоднородной (гетерогенной) смеси:
- Отстаивание, фильтрование, действие магнитом
2. Основные способы выделения веществ из однородной (гомогенной) смеси:
- выпаривание, кристаллизация, дистилляция, хроматография
Состав смесей: объемная и массовая доли компонентов смеси, массовая доля примесей.
Мерой, указывающей доли веществ в смеси, является концентрация.
1.Для жидких и твёрдых смесей массовая доля компонента (w) рассчитывается по формуле:

2. Объёмная доля компонента газообразной смеси (φ) рассчитывается по формуле:

3. Используя материал пунктов 1 и 2, выведите формулы для расчётов:




m (раствора)=V*ρ
1. В 40 г дистиллированной воды растворили 2 г хлорида натрия. Рассчитайте массовую долю соли в полученном растворе.
2. Сколько воды и соли нужно взять, чтобы приготовить 250 г 10%-го раствора нитрата натрия?
3. К 1 кг 60%-го раствора соли добавили 50 г этой соли. Какова массовая доля соли в полученном растворе? Ответ округлить до десятых.
4. Смешали 120 г 40%-го и 280 г 10%-го раствора азотной кислоты. Определите массовую долю азотной кислоты в полученном растворе.
В 2 л раствора серной кислоты содержится 456 г H2SO4. Рассчитайте массовую долю растворённого вещества, учитывая, что плотность раствора равна 1,14 г/мл.
Вопросы для самоконтроля
1) Что такое чистое вещество?
2) Что такое смесь?
3) Сравните чистое вещество и смесь.
4) Классификация смесей по агрегатному состоянию.
5) Перечислите способы разделения смесей.
6) Для борьбы с болезнями растений, особенно плодовых деревьев и виноградников применяют раствор сульфата меди (II). Обычно растворяют 100 г соли на ведро воды (8 л). Какова массовая доля соли в полученном растворе? Сколько воды и соли содержится в 500 г этого раствора?
7) Сколько граммов воды и спирта нужно взять для приготовления 30 г 5% -го раствора йодной настойки?
ПЛАН ЗАНЯТИЯ № 10
Дисциплина: Химия.
Тема: Дисперсные системы.
Цель занятия: Расширить представление о дисперсной системе, дисперсной фазе и дисперсионной среде, классифицировать дисперсные системы, ввести понятие о коллоидных системах.
Планируемые результаты
Предметные: владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой; владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением, экспериментом; умение обрабатывать, объяснять результаты проведенных опытов и делать выводы; готовность и способность применять методы познания при решении практических задач;
Метапредметные: использование абстрактного мышления, умение классифицировать и делать выводы, продолжить развитие химической речи, обогащать ее словарный запас при устных ответах и грамотное выполнение при самостоятельных заданиях.
Личностные: умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
Норма времени: 2 часа
Вид занятия: Лекция.
План занятия:
1- Понятие о дисперсной системе.
2- Дисперсная фаза и дисперсионная среда.
3- Классификация дисперсных систем.
4- Понятие о коллоидных системах.
Оснащение: периодическая система химических элементов Д. И. Менделеева, образцы различных дисперсных систем.
Литература:
1. Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил..
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.