Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид – ионов ОН—.
1. Изменение цвета индикаторов:
фенолфталеин – малиновый
лакмус – синий
метиловый оранжевый – желтый
2. Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
2NaOH + H2SO4 → Na2SO4 + 2H2O,
растворимое
Cu(OH)2 + 2HCI → CuCI2 + 2H2O.
нерастворимое
3. Взаимодействие с кислотными оксидами:
2NaOH + SO3 → Na2SO4 + H2O
4. Взаимодействие с амфотерными оксидами и гидроксидами:
а) при плавлении:
2NaOH + AI2O3 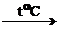 2NaAIO2 + H2O,
2NaAIO2 + H2O,
NaOH + AI(OH)3 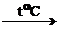 NaAIO2 + 2H2O.
NaAIO2 + 2H2O.
б) в растворе:
2NaOH + AI2O3 +3H2O → 2Na[AI(OH)4],
NaOH + AI(OH)3 → Na[AI(OH)4].
5. Взаимодействие с некоторыми простыми веществами (амфотерными металлами, кремнием и другими):
2NaOH + Zn + 2H2O → Na2[Zn(OH)4] + H2 
2NaOH + Si + H2O → Na 2SiO3 + 2H2 
6. Взаимодействие с растворимыми солями с образованием осадков:
2NaOH + CuSO4 → Cu(OH)2  + Na2SO4,
+ Na2SO4,
Ba(OH)2 + K2SO4 → BaSO4  + 2KOH.
+ 2KOH.
7. Малорастворимые и нерастворимые основания разлагаются при нагревании:
Ca(OH)2 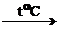 CaO + H2O,
CaO + H2O,
Cu(OH)2 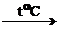 CuO + H2O.
CuO + H2O.
голубой цвет черный цвет
Химические свойства амфотерных оснований:
Амфотерные гидроксиды проявляют свойства оснований и кислот, поэтому взаимодействуют как с кислотами, так и с основаниями.
1. Взаимодействие с кислотами с образованием соли и воды:
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O.
2. Взаимодействие с растворами и расплавами щелочей с образованием соли и воды:
AI(OH)3 + NaOH  Na[AI(OH)4],
Na[AI(OH)4],
AI(OH)3 + NaOH  NaAIO2 + 2H2O.
NaAIO2 + 2H2O.
3. Взаимодействие с кислотными и основными оксидами:
2Fe(OH)3 + 3SO3 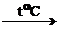
 Fe2(SO4)3 + 3H2O,
Fe2(SO4)3 + 3H2O,
2Fe(OH)3 + Na2O 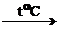 2NaFeO2 + 3H2O.
2NaFeO2 + 3H2O.
Основные способы получения оснований.
1. Взаимодействие активного металла с водой:
2Na + 2H2O → 2NaOH + H2 
Ca + 2H2O → Ca(OH)2 + H2 
Mg + 2H2O 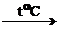 Mg(OH)2 + H2
Mg(OH)2 + H2 
2. Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
3. Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4H2O 
 2NaOH + 2H2
2NaOH + 2H2  + CI2
+ CI2 
4. Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4 
MgSO4 + 2NaOH → Mg(OH)2  + Na2SO4.
+ Na2SO4.
Вопросы для самоконтроля
1 - Дайте характеристику С и (OH)2.
2 - Запишите уравнения реакций, подтверждающие его основные свойства.
1. С и (OH)2
2. С и (OH)2 + … = СиSO4 + …
3. С и (OH)2 + SO3= … + H2O
4. С и (OH)2 + … = С иSO4 + 2NaOH
3 - Напишите уравнения возможных реакций (молекулярные и сокращённые ионные).
ü Гидроксида натрия с нитратом кальция
ü Гидроксида калия с нитратом железа (11)
ü Гидроксида натрия с хлоридом железа (111)
ü Гидроксида калия с хлоридом алюминия.
ПЛАН ЗАНЯТИЯ № 15
Дисциплина: Химия.
Тема: Соли и их свойства.
Цель занятия: Изучить понятие солей в свете теории электролитической диссоциации, углубить знания о свойствах солей и способах получения.
Планируемые результаты
Предметные: владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
Метапредметные: применение основных методов познания (наблюдения, научного эксперимента) для изучения различных сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться в профессиональной сфере;
Личностные: химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
Норма времени: 2 часа
Вид занятия: Лекция.
План занятия:
1. Соли как электролиты.
2. Соли средние, кислые и оснóвные.
3. Химически свойства солей в свете теории электролитической диссоциации.
4. Способы получения солей.
Оснащение: Интерактивная доска, таблица растворимости, ряд активности металлов и кислот.
Литература:
1. Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил..
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.