Защитные мероприятия начинают на стадиях проектирования и производства изделий и продолжают в процессе их эксплуатации.
Способы защиты металлов от коррозии делятся на следующие группы:
I. Способы, основанные на изменении химических, физико-химических или электрохимических свойств металлов. К ним относятся:
1. Легирование металлов.
2. Изоляция металлов путем нанесения защитных покрытий.
3. Электрохимическая защита.
II. Способы, основанные на изменении свойств агрессивной среды.
Рассмотрим все эти способы защиты металлов подробнее.
1. Легирование металлов. Это введение в металл добавок других металлов, которые повышают его коррозионную устойчивость и увеличивают прочность защитных пленок. При добавлении к железу Cr, Mo, Ni, Mn, W, Al в качестве легирующих добавок получают нержавеющие стали. Такие стали не покрываются ржавчиной, а их поверхностная коррозия протекает с малой скоростью.
При изменении концентрации легирующих добавок коррозионная стойкость металлов меняется скачкообразно. Так, резкое повышение коррозионной устойчивости железа наблюдается при введении легирующей добавки в количестве 1/8 атомной доли, то есть один атом легирующей добавки приходится на восемь атомов железа. Считается, что при таком соотношении атомов происходит их упорядоченное расположение в металлической решетке, что затрудняет коррозию.
Особенности легирования железа различными металлами:
Хром. Обладает высокой склонностью к пассивации в средах с различными значениями рН. Устойчив к питтинговой коррозии. Пассивность хрома обусловлена образованием на его поверхности слоя оксида Cr2O3.
Никель. Основным недостатком хромистых сталей является их высокая склонность к хрупкому разрушению. Для преодоления этого недостатка хромистые стали легируют никелем, который придает им прочность и пластичность. Основным недостатком хромоникелевых сталей является их низкая устойчивость к коррозионному растрескиванию.
Молибден. Его вводят в хромоникелевые нержавеющие стали для повышения их коррозионной стойкости. Молибден улучшает пассивируемость сталей в неокислительных средах и снижает их склонность к питтинговой и щелевой коррозии.
Вольфрам. Основным недостатком хромникельмолибденовых сталей является их низкая стойкость в окислительных средах. Для преодоления этого недостатка их дополнительно легируют вольфрамом.
Медь. Легирование сталей медью повышает их коррозионную устойчивость в растворах минеральных кислот.
Для защиты от сероводородной коррозии эффективно легирование металлов хромом, алюминием, молибденом и кремнием.
Существует способ повышения устойчивости металла, основанный не на введении легирующих добавок, а наоборот, на удалении из него примесей, усиливающих коррозию.
2. Защитные покрытия. Они изолируют металлическую поверхность изделий, в т.ч. нефте-, газотрубопроводов, от агрессивной среды и делятся на металлические, неметаллические и химические.
Для защиты от ЭХК применяют металлические покрытия, которые делятся на анодные и катодные. Для получения анодного покрытия на защищаемый металл наносят слой более активного металла. Например, железо покрывают цинком, в этой паре цинк – анод, а железо – катод. Если цинковое покрытие не повреждено, то железо корродировать не может. При повреждении покрытия в среде электролита возникает МГЭ и начинается ЭХК. При этом будет разрушаться анод, т.е. само покрытие, но не защищаемый металл. Поэтому анодные покрытия применяются в случае большой вероятности их повреждения.
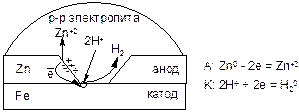 |
Схема работы МГЭ, возникающего в кислой среде при повреждении анодного покрытия:
Катодные покрытия делают из металла, менее активного, чем защищаемый металл. Например, для катодного покрытия железа используют олово. При повреждении катодного покрытия в токопроводящей среде возникает МГЭ, в котором олово будет катодом, а железо – анодом, которое и будет подвергаться коррозии. Поэтому катодные покрытия применяются при небольшой вероятности их повреждения (например, для внутреннего покрытия консервных банок или для покрытия церковных куполов).
Схема работы МГЭ в кислой среде при нарушении катодного покрытия:
 |
В нейтральной и щелочной средах ЭХК протекает аналогично с участием О2 в роли деполяризатора (K: O2 + 2H2O + 4e → 4OH-).
Металлические покрытия применяют также для защиты металлов от ХК. Такие покрытия часто изготавливают из достаточно активного металла, который в условиях эксплуатации защищаемого изделия имеет повышенную коррозионную стойкость. Примеры: горячее алюминирование, оцинкование, хромирование.
Неметаллические покрытия бывают органические и неорганические. К органическим относятся лаки, краски, битумы, полимеры, резины. К неорганическим относятся покрытия из эмалей и бетонов. Лаки и краски наиболее эффективны в условиях атмосферной коррозии. Для защиты подземных сооружений и конструкций они, как правило, непригодны вследствие неизбежного их повреждения при контакте с грунтом.
Химические покрытия – это коррозионно стойкие неметаллические пленки, которые получают химической обработкой поверхности металла различными окислителями. Эти покрытия делятся на оксидные, фосфатные, хроматные, нитридные и др. Например, оксидные пленки получают взаимодействием поверхности металла с атомарным кислородом при высокой температуре или методом электролиза (анодированием).
Защитные покрытия образуются также в случае ингибиторной защиты. Она заключается в нанесении на поверхность металла ингибиторов, замедляющих скорость коррозии. Неорганические ингибиторы (Na2CrO4, NaNO2, Na2SiO3) при взаимодействии с металлами образуют на их поверхности труднорастворимые защитные пленки. Органические ингибиторы (ароматические амины и спирты, многоатомные фенолы, тиомочевина, уротропин) образуют защитный слой в результате их химической адсорбции поверхностью металла.
К ингибиторным способам можно отнести обработку ядохимикатами почвы, контактирующей с трубопроводом. Этот прием снижает интенсивность жизнедеятельносги микроорганизмов и используется для защиты от биокоррозии.
Основные требования к изоляционным покрытиям, применяемые на трубопроводах:
а) высокие диэлектрические свойства;
б) высокая степень сплошности защитных пленок;
в) хорошая адгезия (прилипаемость) к металлу трубопровода;
г) водонепроницаемость;
д) высокая механическая прочность и эластичность;
е) высокая биостойкость;
ж) термостойкость: покрытие не должно размягчаться под воздействием высоких температур и не становиться хрупким при низких температурах.
Для противокоррозионной защиты подземных трубопроводов используют покрытия на основе полимерных материалов – полиэтилена, полипропилена, полиуретанов, термоусаживающихся и термореактивных полимеров, эпоксидных красок, полимерных липких лент, битумных и асфальтосмолистых мастик. Они могут наноситься как при изготовлении труб, так и при их эксплуатации.
На участках со сложными почвенно-климатическими условиями, и особенно на подводных переходах, где трубы нередко укладываются методом протаскивания, к изоляционным покрытиям предъявляются особо высокие требования: значительная механическая прочность, низкая степень истираемости, высокая адгезия к металлу, химическая стойкость, долговечность. В этих условиях используют антикоррозионные покрытия из полиуретанов. Полиуретаны обладают высокими изолирующими свойствами, значительной твердостью, эластичностью, чрезвычайно высоким сопротивлением истиранию, царапанию и биоповреждениям. Они стойки к воде, растворам солей и обладают хорошей адгезией к металлам.
3. Электрохимические способы защиты.
Практика показывает, что изоляционные покрытия не гарантируют необходимой защиты металлических изделий, в т.ч. подземных трубопроводов от коррозии по следующим причинам:
а) в процессе эксплуатации они теряют свои диэлектрические свойства, водоустойчивость, адгезию;
б) в покрытиях остается некоторое количество незамеченных при проверке дефектов.
В связи с этим защиту металлических изделий и трубопроводов от подземной коррозии осуществляют защитными покрытиями в сочетании со средствами электрохимической защиты (ЭХЗ). К ним относятся протекторная защита, электрозащита и электродренажная защита.
3.1. Протекторная защита. Она заключается в том, что к защищаемому изделию присоединяют протектор, состоящий из более активного металла. Возникает накоротко замкнутый гальванический элемент, в котором изделие является катодом, а протектор – анодом. Поэтому разрушаться будет протектор. В качестве протекторов используют отходы цинкового производства и старые изделия из магниевых сплавов. Этим способом защищают гребные винты морских судов, подземные трубопроводы и сооружения.
Схема установки для протекторной защиты трубопроводов:

1 – трубопровод; 2 – контакт; 3 – контрольно-измерительная колонка; 4 – изолированный провод; 5 – протектор; 6 – активатор; 7 – насыпной грунт
Электроотдача одного протектора невелика, поэтому иногда в установку включают несколько протекторов. Для их изготовления используют сплавы на основе магния, цинка или алюминия, у которых электродный потенциал более отрицательный по сравнению с железом. Лучший эффект в почвенных условиях дают магниевые сплавы. Внутри протектора помещают контактный стальной стержень для подключения кабеля. Для повышения эффективности работы протектора его погружают в специальную смесь солей, называемую активатором.
Преимуществом протекторной защиты является возможность ее использования в местах отсутствия источников электроэнергии. Однако она имеет и существенные недостатки: а) протектор быстро расходуется, что требует его частой замены; б) радиус действия протекторной защиты не более 50 м. Поэтому чаще используют электрозащиту, или метод внешнего потенциала.
3.2. Электрозащита. Она бывает катодной или анодной.
При катодной защите изделие подключают к катоду источника постоянного тока, а его анод подключают к вспомогательному электроду, например куску старого рельса, или замыкают на землю, например при защите газо- и нефтепроводов. В результате на защищаемом изделии возникает избыточный отрицательный заряд, оно становится катодом и не разрушается. Коррозии подвергается вспомогательный электрод, который выполняет роль анода.
Принципиальная схема катодной защиты:

1 — источник постоянного тока; 2 — изолированный электропровод; 3 — трубопровод с поврежденной изоляцией (катод); 4 — заглубленный железный анод; 5 — дренаж (соединение трубы с электропроводом).
Радиус действия катодной защиты достигает 2 км. Она применяется для повышения стойкости металлических сооружений в условиях почвенной и морской коррозии, а также при контакте металлов с агрессивными химическими средами. На практике катодная защита редко применяется без дополнительных мероприятий. Требуемый для полной защиты ток обычно бывает чрезмерно велик, и помимо дорогостоящих электрических установок для его обеспечения, он часто вызывает вредный побочный эффект, например чрезмерное защелачивание почвы. Поэтому катодная защита применяется в сочетании с некоторыми видами покрытий. Требуемый при этом ток мал и служит только для защиты непокрытых участков поверхности металла.
При анодной защите изделие подключают к аноду источника тока, а катод соединяют со вспомогательным электродом. При этом электродный потенциал защищаемого металла сдвигается в сторону более положительных значений, вследствие чего его коррозионная стойкость повышается. Применение анодной защиты целесообразно в сильноагрессивных средах, например в химической промышленности. Она применяется для защиты аппаратуры из стали, титана или др. металлов, например, для предотвращения коррозии нержавеющих сталей при их контакте с серной кислотой.
3.3. Электродренажная защита.
Значительную опасность для магистральных трубопроводов представляют блуждающие токи электрифицированных железных дорог, которые в случае отсутствия защиты трубопровода вызывают его интенсивную коррозию в т.н. «анодных зонах». Наиболее эффективным способом защиты от блуждающих токов является электродренажная защита. Ее принцип состоит в устранении анодных зон путем дренажа, т.е. отвода от них блуждающих токов в рельсовую часть железнодорожных путей.
II. ЭХК замедляют также уменьшением агрессивных свойств окружающей среды. Существует два способа:
1. Удаление из окружающей среды или снижение концентрации веществ, способствующих коррозии, например, снижение концентрации кислорода в воздухе или кислоты в растворе. Концентрацию ионов водорода в водных растворах уменьшают добавлением неорганических и органических оснований. Содержание кислорода в растворах электролитов снижают следующими способами:
а) путем химического связывания кислородами восстановителями, например: 2Na2SO3 + O2 → 2Na2SO4;
б) термическим способом: при нагревании воды или раствора электролита растворимость кислорода снижается, и он десорбируется из агрессивной среды;
в) путем пропускания через раствор инертного газа, что также способствует десорбции кислорода.
Для снижения агрессивности газовой среды в нее вводят такие компоненты, как азот, оксиды углерода, водяной пар, водород.
2. Ингибиторная защита путем добавления ингибиторов в агрессивную среду.
Ингибитором в данном случае называется вещество, при добавлении которого в агрессивную среду в небольших количествах скорость коррозии металла значительно уменьшается. Такие ингибиторы применяют, главным образом, в системах, работающих с постоянным или мало обновляемым объемом раствора, например, в некоторых химических аппаратах, системах охлаждения, парогенераторах и т.п. Они применяются при транспортировке газа и нефти, для защиты от коррозии горюче-смазочными веществами, а также в органических средах, морской воде и т.д. Особенно большое применение ингибиторы находят в процессах травления металлов для удаления с поверхности окалины или ржавчины.
Эффективность ингибиторного действия определяется условиями среды, поэтому универсальных ингибиторов не существует. Ингибиторы со временем расходуются, поэтому они должны периодически добавляться в агрессивную среду, при этом их расход невелик. Например, нитрит натрия добавляют в количестве 0,01-0,05% от количества агрессивной водной среды.
Способы классификации ингибиторов:
1. По химическому составу различают органические и неорганические ингибиторы.
2. По условиям применения существуют ингибиторы для растворов и летучие ингибиторы, дающие защитные эффект в условиях атмосферной коррозии.
3. Эффективность действия ингибиторов сильно зависит от величины рН среды. Поэтому ингибиторы делятся на кислотные, щелочные и нейтральные. Например, часто применяемый нитрит натрия может использоваться в основном в щелочной среде и перестает быть эффективным даже в слабокислых средах. В качестве ингибиторов кислотной коррозии используются N-, S-, O-содержащие соединения – амины, тиофены, карбоновые кислоты, альдегиды и др.
Рассмотренные методы защиты от коррозии делят на 3 группы:
1. Конструкционные методы, которые разрабатываются на стадии проектирования металлических конструкций. Они основываются:
а) на использовании коррозионно стойких материалов (нержавеющих сталей, кортеновских сталей, некоторых цветных металлов);
б) на максимально возможной изоляции изделий от коррозионной среды за счет применения клеев, герметиков, резиновых прокладок и т.п..
2. Активные методы. В их основе лежат электрохимические методы защиты.
3. Пассивные методы. К ним относятся различные типы покрытий.