Концентрации, которые соответствуют химическому равновесию, называются равновесными концентрациями. Связь между равновесными концентрациями устанавливается законом действующих масс (ЗДМ). Этот закон в 1867 г. вывели К. М. Гульберг и П. Вааге.
Кинетический вывод ЗДМ
f – фугитивность – парциальное давление для реальных газов. Возникает вопрос, будут ли равняться Кpи Кс.
Кpи Кc– отличаются на RT?vi в сумме стехиометрических коэффициентов.
Связь между Кpи Кс
если?vi = 0, то Kp = Kc.?vi = 1 + 1 – 1 – 1 =0 – когда стехиометрический коэффициент = 1.
Закон действующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Неизменные при данных температуре и давлении концентрации компонентов системы, в которой установилось равновесие, называют равновесными. Связь между равн. Концентр. Всех реагентов и продуктов реакции выражает закон действующих масс: Отношение произведений концентраций продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к произведению концентраций реагентов, также взятых в степенях, равных их стехиометрическим коэффициентам, является постоянной величиной.
Эта постоянная называется константой равновесия. Чем полнее происходит превращение исходных веществ в продукты реакции, тем больше числовое значение константы равновесия.
4.Чем характеризуется термин «область малой подвижности» в образовании оксидов азота?
5. При сжигании каких топлив возможно образование «топливных» NO?
Работы различных ученых показали, что азотсодержащие соединения, входящие в состав топлив, также являются источником образования оксидов азота, поступающих в атмосферу с продуктами сгорания.
В России особое значение изучение механизма образования “топливных” оксидов азота имеет в связи с проблемой сжигания Канско-Ачинских (Np=0,6-1,1%) и некоторых других бурых углей. Сжигание их осуществляется при весьма низких температурах (1600-1700) К, при которых выход “термических” NOx невелик, а выход “топливных” NOx приобретает существенное значение (при 1600 К он может составлять до 75% общего выхода NOx). Некоторые данные о содержание связанного азота в топлива, применяемых на территории бывшего СССР, приведены в следующих таблицах:
(Содержание азота в углях некоторых месторождений).
| Месторождение | Марка угля | Nг, % |
| Донецкое Кузнецкое Кузнецкое Кузнецкое Нерюнгринское Экибастузское Печорское Березовское | АШ Т 2СС ГЖ СС СС Д БЗ | 0,8 2,1 1,9 2,2 1,0 1,2 2,7 0,95 |
(Содержание азота в жидком топливе, %)
| Топливо | Nг,% |
| Топочный мазут Сланцевое масло Моторное Дизельное Газотурбинное: лёгкое тяжелое | 0,30-0,50 0,14-0,50 0,12-0,13 0,007-0,01 0,02-0,03 0,07-0,09 |
Топливные NOx образуются из азотосодержащих соединений топлива при продувании его горячим воздухом уже при температуре 900-1000 К. Во всяком случае при температурах 1000-1400 К на начальном участке факела, где происходит воспламенение и горение летучих, обнаруживается значительный выход NOx.
Если бы всё количество азота, содержащегося в топливе, окислялось до NO, то только за счёт топливного азота могло бы образоваться при горении углей до 2-4 г/м^3, при горении мазута до 0,5-1,0 г/м^3. В действительных процессах лишь некоторая часть топливного азота переходит в оксиды азота. Азотосодержащие соединения в углях состоит из аминов, пептидов, аминокислот и др. При нагреве угля в корне факела в зоне выхода летучих обнаруживаются пиридины, хинолины и другие смолистые вещества, аммиак. Значительная часть азотосодержащих соединений, однако, переходит не в эти соединения, а в более прочные - нитриды и др. Однако поскольку для превращения топливного азота, входящего в такие соединения, как пиридины, хинолины, нитробензол, нитроамины, аммиак и некоторые другие, а также на образование NO, требуется меньшая энергия, чем энергия расщепления молекулы N2, образование существенных количеств NO даже при сравнительно невысоких температурах (1300-1400 С) вполне возможно.
Параллельно описанной выше одной из теорий, проходили и другие изучения на основании которой были сделаны следующие выводы:
Азотосодержащие соединения топлива при горении частично окисляются до NO, и влияние этого процесса на общее содержание оксида азота в продуктах сгорания должно быть учтено.
Влияние топливных NOx на общий выброс оксида азота более существенно при низких температурах процесса горения (Tmax<1800 K), например, при сжигании низкокачественных углей, особенно при сжигании топлива в кипящем слое, при горении мазута, антрацитов и других высокореакционных топлив в крупных топливосжигающих установках влияние топливных NOx меньше.
Образование топливных оксидов азота происходит на начальном участке факела, в области образования “быстрых” NO и до образование “термических” NO.
Степень перехода азотосодержащих соединений топлива в NO уменьшается с увеличением концентрации азота в топливе. Однако абсолютный выход NO при большем содержании азота топлива будет выше.
Степень перехода азотосодержащих соединений топлива в NO быстро нарастает с увеличением коэффициента избытка.
Выход топливных NO сравнительно слабо (особенно по сравнению с термическим NO) зависит от температуры процесса.
Вид азотосодержащего соединения и содержание кислорода в топливе не оказывают влияния на выход топливных NO.
Из способов снижения образования “топливных” NOx наиболее подробно испытаны методы ступенчатого сжигания топлива.
Выводы.
Выше было показано, что оксид азота может образоваться по трём известным механизмам:
“термическому”, в результате диссоциации молекул на атомы и радикалы и последующего окисления молекул азота, он исходит из значительной зависимости выхода NO от температуры, что качественно подтверждается исследованиями на крупных промышленных установках;
“быстрому”, действующему в начале зоны горению, в основу которого положены реакции с участием радикалов СН, СН2, он определяет минимальный выход NO при горении газового топлива, слабо зависит от температуры и сильно от структуры молекулы топлива;
“топливному”, зависящему от содержания азота в топливе и избытка воздуха.
Образование диоксида азота в процессах горения.
В течении ряда лет существовало мнение, что оксиды азота образуются в процессах горения в виде монооксида азота и лишь после выхода из дымовой трубы доокисляются в диоксид. Однако при сжигании богатых смесей и при сжигании газовоздушных смесей, по составу близких к стехиометрическим, было зафиксировано в предпламенной зоне до 14 мг/м^3 диоксида азота. Во фронте пламени существенных количеств NO2 обнаружить не удалось, что можно объяснить разложением NO2 в ходе реакции:

Так же не исключены и другие реакции разложения NO2.
Образование NO начинается на расстоянии 1 мм от видимого фронта пламени и достигает максимума во фронте пламени. Отношение NO2/NO уменьшается с повышением температуры. Разложение NO2 происходит за период = 4*10^-3 с на отрезке длинной 1 мм от начальной границы видимого фронта пламени. Зона разложения предпламенной NO2 во фронте пламени совпадает с зоной образования “быстрых” NO, т.е зоной интенсивного нарастания концентраций оксида азота. Эффект разложения NO2 в факеле известен и начинает использовать с целью очистки газов, содержащих высокие концентрации NO2 (отходящие газы химической и других отраслей промышленности).
Процесс доокисления NO в NO2 в пламенах молекулярным кислородом имеет высокую энергию активации реакций и большое время реагирования, поэтому существенных количеств NO2 он дать не может. Из двух наиболее вероятных окислителей NO в NO2 (атомарный кислород и пероксидный радикал - HO2) практически значение имеет лишь НО2. Доокисление NO в NO2 происходит за счёт реакции с пероксидным радикалом и имеет место при сильном охлаждении пламен избыточным воздухом и водоохлаждаемыми поверхностями нагрева:
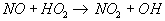
“Время жизни” НО2 составляет от 10^-4 с до (2-3)*10^-2 с. Процесс окисления лимитируется только количеством НO2, так как концентрация NO существенно выше, чем радикальность НO2.
В области минимальных температур в зоне горения при содержании NO в продуктах сгорания 100-120 мг/м^3 время реагирования не превышает 10^-4 с, т.е можно считать, что при наличии НO2 NO практически мгновенно переходит в NO2 и только недостаточное количество НO2 препятствует полному доокислению NO в NO2. Всё количество пероксидного радикала, вынесенного из зоны горения в результате диффузионного процесса в предпламенную и послепламенную области, прореагирует с образованием NO2.
Критическая температура, ниже которой происходит образование NО2 в пламенах, равна 977 К. Резкое охлаждение продуктов сгорания имеет место в частности, в малых отопительных котлах. Время, необходимое для достижения частицей, находящейся во фронте пламени, наиболее удаленной экранной поверхности, невелико и составляет 0,10-0,12 с, что создает благоприятные условия для образования пероксидных радикалов и способствует образованию значительных количеств диоксида азота в продуктах сгорания топлива в отопительных котлах.