Лекция 13
Фазовые равновесия. Правило фаз Гиббса. Диаграммы состояния однокомпонентных систем
План:
Фазовое равновесие
Правило фаз Гиббса
Число степеней свободы, компоненты, фазы
Диаграммы состояния однокомпонентных систем
Фазовое равновесие
К гетерогенным равновесиям относится фазовое равновесие. Фазовое равновесие - это термодинамическое равновесие в гетерогенной системе, в которой не происходит химического взаимодействия, а имеют место только процессы перехода из одной фазы в другую. Качественная характеристика таких равновесных систем дается правилом фаз Гиббса. Оно основано на 2-ом законе термодинамики и относится к системам, находящимся в состоянии истинного равновесия.
Правило фаз Гиббса: в равновесной многофазной системе число степеней свободы равно числу компонентов плюс два, минус число фаз.
С = К + 2 - Ф или Ф + С = К + 2,
Где С – число степеней свободы
К – число компонентов
Ф – число фаз в системе
Число степеней свободы, компоненты, фазы
Число степеней свободы – характеризует вариантность системы, т.е. число независимых переменных (Р, Т и С), которые можно произвольно изменять в некоторых пределах так, чтобы число равновесных фаз в системе осталось неизменным.
Например, состояние идеального газа характеризуется 3-мя параметрами Р, V, Т. Число степеней свободы для него равно двум, что соответствует 2-м произвольно заданным параметрам: Р и Т, Р и С, С и Т, а третий будет определен из уравнения состояния. Лишенную степеней свободы систему например:
[ лед ] ↔ {вода} ↔ (пар)
предложено называть инвариантной, если (С = 0).
моновариантной, если (С = 1),
бивариантной, если (С = 2).
Компонентами называются независимые составляющие, наименьшего числа которых вполне достаточно чтобы построить любую фазу в системе, находящейся в равновесии. В физических системах число компонентов равно числу составляющих систему веществ, т.к. вещества не вступают между собой в химическое взаимодействие.
Например, физическая система состоящая из воды, льда и водяного пара при 0,010С и 612 Па, однокомпонентна, поскольку для формирования всех 3-х фаз в системе достаточно одного индивидуального вещества – воды. Она инвариантнат.к. нельзя изменить ни Т, ни Р в системе, не изменив числа фаз.
В химических системах число компонентов меньше числа составляющих веществ на число уравнений, по которым вещества, образующие систему, обратимо реагируют между собой. Рассмотрим на конкретном примере подсчет числа компонентов химической системы:
CaCO3(тв)  CaO(тв) + СО2(г)
CaO(тв) + СО2(г)
(равновесная гетерогенная система)
Составляющих веществ – 3.Число уравнений их связывающих в системе равно одному. Число компонентов К = 3 – 1 = 2. Значит эта система двухкомпонентна.
Фазой называется гомогенная частьгетерогенной системы, обладающая одинаковым химическим составом и термодинамическими свойствами, ограниченная поверхностью раздела.
Диаграммы состояния однокомпонентных систем
Диаграммы, отражающие зависимость физических свойств от состава, которые не могут быть представлены в виде функции только давления, температуры и концентрации – называются диаграммами состав - свойство.
Рассмотрим диаграмму физической равновесной однокомпонентной системы
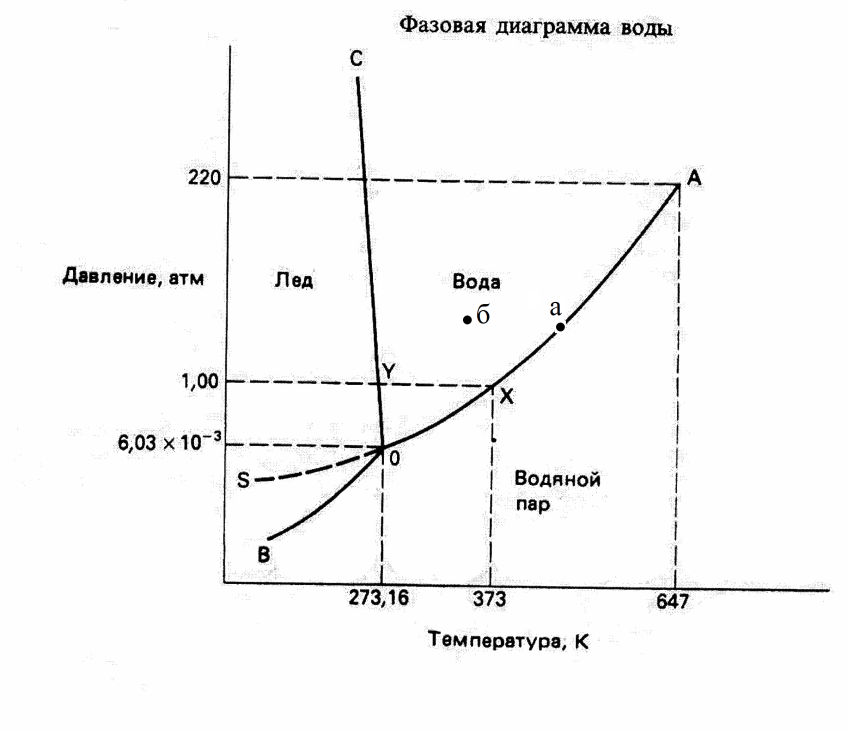
В условиях равновесия, три области диаграммы, соответствующие существованию воды в твердом, жидком и газообразном состояниях, разграничиваются тремя кривыми линиям, которые сходятся в общей точке О. Кривая ОА разделяющая жидкое и газообразное состояние, определяет значения Р и Т, при которых осуществляется кипение. Например, при давлении 1атм Ткип= 1000С (x), при более низких давлениях Ткип соответственно понижается. В частности вода может кипеть при комнатной температуре, если снизить давление над поверхностью воды до 0,003атм. И наоборот, повышение давления приводит к возрастанию температуры кипения воды до тех пор, пока не будет достигнута критическая точка А. При температуре, отвечающей этой точке – критической температуре - величины, характеризующие физические свойства жидкости и пара становятся одинаковыми, так что различие между жидким и парообразным состоянием исчезает.
(·) О [ лед] «{вода} «(пар)
(·) О – называется тройной точкой в равновесии сосуществуют три фазы - лед, вода и пар, число фаз = 3.
С = 1 + 2 – 3 = 0 - система инвариантна,
нельзя менять параметры, они должны быть строго постоянными: Т =273К, Р =610,5 Па (6,03∙ 10-3 атм, 4,6 мм.рт.ст.).
Но ни все вещества могут находиться во всех агрегатных состояниях. Так карбонат кальция невозможно получить ни в жидком, ни в газообразном состоянии.
(―) ОА { вода} «(пар) (по линии ОА в равновесии пар и вода)
(―) ОС { вода} «[лед]
(―) ОВ [ лед] «(пар)
Точка (а) – в равновесии 2 фазы, пар и вода. С = 1+ 2 – 2 = 1 – моновариантная система, один из параметров может меняться произвольно, Р или Т.
Точка (б) – в равновесии вода. С = 1 + 2 – 1 = 2 – бивариантная система, могут произвольно меняться 2 параметра Р и С, Т и С.
Изменение фазового состояния вещества, т.е. переход одного физического состояния в другое (например, плавление, испарение, сублимация) всегда приводит к изменению энтальпии. Температура, при которой происходит фазовое превращение называется температурой перехода.
Вопросы для самоконтроля:
1. Когда в системе устанавливается фазовое равновесие?
2. Сформулируйте правило фаз Гиббса
3. Дайте определение понятиям «число степеней свободы», «компонент», «фаза».
4. Опишите диаграмму состояния однокомпонентной системы, назовите основные части диаграммы.