ОВР — окислительно-восстановительные реакции. Это процессы, связанные с передачей электронов. Длинные и скучноватые определения, которыми кормят в школе, в общем-то, остаются быть справедливыми. Окислитель — атом, принимающий электрон(ы) и понижающий степень окисления. Восстановитель — атом, отдающий электрон(ы) и повышающий степень окисления. Для более простого восприятия пока можно заменить термины. Окислитель — это кислород (в неорганике это может быть другое вещество, например KMnO4, но неорганики больше не будет). Восстановитель — топливо. Это может быть уголь, природный газ, а для человеческих тушек — сахарок, бутербродики и прочая нямка. Тогда ОВР, немного упрощенно — это горение. Горение достаточно подробно изучено в курсе школы, если кто хорошо учил органику. Это одна из самых лёгких реакций школьного курса. Почти всем известно, что:
Любое органическое вещество + О2 = СО2 + Н2О
Например
СН4 + 2 О2 = СО2 + 2 Н2О
— горение метана. Из чисто бытовых соображений известно, что горение газа на кухне синим цветком сопровождается выделением приличного количества тепла — можно поставить чайник, сварить пельмешек или чего посущественее. В первом семестре мы даже научились считать, сколько выделится тепла, если помните — закон Гесса, энтальпия реакции = энтальпия продуктов – энтальпия исходных. Не утомляя читателя длинными расчётами, заметим, что при сгорании литра метана выделяется 35,88 Килоджоулей. Много это или мало — сложно сказать. Однако, если бы газовая горелка грела только чайник, и не грела бы воздух, окружающую среду и сидящего рядом студента, хватило бы вскипятить 8-литровый чайник. Это всё круто, ежу понятно — чтобы ходить, говорить, искать себе еду и партнёра для спаривания, скроллить ленту ВК и Инсте и других дел человеку нужна энергия. Однако прямое горение как способ получения энергии для человеческой тушки совершенно не подходит. По очевидным причинам — горячо же! Поэтому процесс окисления топлива в организме идет:
1) по стадиям, не сразу до СО2 и Н2О, а с кучей промежуточных. Это позволяет получать энергию не РЕЗКО, а плавно.
2) Выделяющаяся энергия превращается не в тепло, как при горении, а в энергию химических связей.
Тут бы хорошо на минуту задумать, а что такое энергия? Все примерно знают, что это. Вики даёт нам определение, энергия является мерой способности физической системы совершить работу. Которое, впрочем, мало что проясняет. К этому мы вернемся чуть позже.
На втором курсе кафедра биохимии тратит значительное время, чтобы объяснить простую вещь. Катаболизм — это когда при окислении (читай: горении) органических веществ в организме выделяется энергия. Анаболизм — это когда энергия тратится на синтез собственных сложных веществ. Метаболизм — сумма этих двух процессов. Связь между катаболизмом и анаболизмом осуществляется за счёт аденозинтрифосфата (АТФ) — молекулы с макроэргической связью. Сам по себе АТФ выглядит вот так (рис. 1):
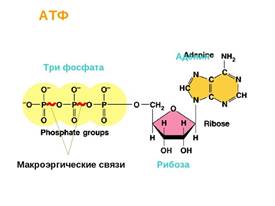 Сложные биоорганические молекулы надо воспринимать как некий конструктор: аденин + рибоза + 3 фосфата. Пусть мы пока и не помним наизусть, как выглядит аденин, это неважно. Функция АТФ – хранение энергии в виде связи между 2 и 3 фосфатами. Связь очень неустойчива и быстро разрывается с выделением большого количества энергии. То есть существует равновесие АДФ + Ф ↔ АТФ, где АДФ — аденозинДИфосфат, Ф — фосфат, АТФ — аденозинтрифосфат. АДФ + Ф воспринимают энергию окисления, соединяются и образуют высокоэнергетическую связь. Если есть потребность в энергии — связь разрывается, освобождая её.
Сложные биоорганические молекулы надо воспринимать как некий конструктор: аденин + рибоза + 3 фосфата. Пусть мы пока и не помним наизусть, как выглядит аденин, это неважно. Функция АТФ – хранение энергии в виде связи между 2 и 3 фосфатами. Связь очень неустойчива и быстро разрывается с выделением большого количества энергии. То есть существует равновесие АДФ + Ф ↔ АТФ, где АДФ — аденозинДИфосфат, Ф — фосфат, АТФ — аденозинтрифосфат. АДФ + Ф воспринимают энергию окисления, соединяются и образуют высокоэнергетическую связь. Если есть потребность в энергии — связь разрывается, освобождая её.
|

А в химии всё намного проще: если у АДФ и Ф есть энергия, то они мутят и образуют соединение АТФ. А когда кончается энергия, АТФ распадается на АДФ и Ф, при этом выделяя энергию. Но потом они снова сойдутся. И снова разойдутся, и так далее, много циклов. В человеке за сутки распадается и вновь образуется больше 30 кг АТФ. А вот Лёша с Леной, походу, уже больше не сойдутся. Напомним, совпадения случайны.
 В отличие от Лены с Лёшей, АТФ получает энергию не из пищи, а из НАД+. НАД+ это такая хитрая молекула, формулу которой мы не приведём, чтобы не портить настроение. Конструкция НАД+ и не так важна, а важна функция — НАД+ отрывает 2 Н+ и 2 электрона от топлива (SH2, это не сера, а субстрат). За счёт этого окисление и выделение энергии происходит небольшими частями. Это можно показать вот так:
В отличие от Лены с Лёшей, АТФ получает энергию не из пищи, а из НАД+. НАД+ это такая хитрая молекула, формулу которой мы не приведём, чтобы не портить настроение. Конструкция НАД+ и не так важна, а важна функция — НАД+ отрывает 2 Н+ и 2 электрона от топлива (SH2, это не сера, а субстрат). За счёт этого окисление и выделение энергии происходит небольшими частями. Это можно показать вот так:
Для примера рассмотрим гипотетическое окисление метана в организме. Человек метаном питаться не может, но как пример сойдёт.
СН4 + НАД+ = СН2 + НАДН + Н+
СН2 + НАД+ = С + НАДН + Н+
С + НАД + + Н2О = СО + НАДН + Н+
СО + НАД + + Н2О = СО2 + НАДН + Н+
Как видно, НАД+, постепенно обдирает Н с топливной молекулы. В каждой стадии образуется НАДН (в нём, напомним, заложено 2е) и Н+. Когда Н кончается, можно ободрать воду, а освободившийся кислород повесить на С, и получится СО2. Углекислый газ отправляется в выдыхаемый воздух, а НАДН посредством довольно хитрой системы, которая называется дыхательная цепь, превращает энергию электронов в энергию связи АТФ. Подробно о дыхательной цепи (она же цепь переноса электронов) — в курсе биохимии. Результат работы дыхательной цепи:
НАДН + Н+ + ½ О2 = НАД+ + Н2О + Энергия
Энергия + АДФ + Ф = АТФ.
Энергия уходит на синтез АТФ, а топливное вещество «сгорает» до СО2 и Н2О, хоть и во много стадий. Когда у организма возникает потребность в энергии, АТФ распадается, освобождая её (как Лёша с Леной). А к чему же вся тема в курсе химии? Она о том, какое вещество как может окисляться. Метан — это простой пример, чтобы понять, как всё это работает. В организме же окисляются более сложные вещества: глюкоза (С6Н12О6), жирные кислоты (СхНуСООН)и прочие. Их окисление включает много больше этапов, этапы специфичны для каждого вещества, каждый этап проходит в определенном месте клетки. Частично эти этапы и раскрыты в теме ОВР в САРС-ах, тестах и прочих хороших местах. Спирт окисляется в альдегид или кетон, альдегид в кислоту и так далее. Подробнее об этом можно почитать в тестовой методичке, в разделе «Введение».