На рис.2. показана кривая, характеризующая зависимость скорости ферментативной реакции от концентрации субстрата. Из рисунка видно, что но этой кривой, которая только приближается к точке, соответствующей максимальной скорости реакции, но никогда ее не достигнет, трудно определить точно, при какой концентрации субстрата устанавливается Vmax. Однако благодаря тому, что эта кривая, представляющая собой гиперболу, имеет одинаковую форму для большинства ферментов, Михаэлис и Ментен определили константу, обозначаемую в настоящее время через Км, при помощи которой удобно выражать точное соотношение между концентрацией субстрата и скоростью катализируемой ферментом реакции. Величину Км, иначе константу Михаэлиса-Ментен, можно определить просто как концентрацию специфического субстрата, при которой данный фермент обеспечивает скорость реакции, равную половине ее максимальной скорости (рис.2.).
Характерная форма кривой насыщения фермента субстратом (рис.2.) может быть выражена математически уравнением Михаэлиса—Ментен

где ʋ0 начальная скорость при концентрации субстрата [S], Vmax - максимальная скорость и Км- константа Михаэлиса-Ментен для данного фермента, соответствующая определенному субстрату.
Вывод уравнения Михаэлиса-Ментен
Для многих ферментов характерна гиперболическая кривая зависимости скорости реакции от концентрации субстрата (рис.2), постепенно приближающаяся к точке, соответствующей насыщению фермента субстратом. Мы уже видели, что такие кривые имеют две основные точки: 1) Км-концентрация субстрата, при которой скорость реакции равна половине ее максимальной скорости, и 2) Vmax _максимальная скорость, т.е. предельное значение, к которому приближается скорость реакции при бесконечно большой концентрации субстрата. Михаэлис и Ментен показали, что из гиперболических кривых насыщения ферментов можно извлечь много дополнительной полезной информации, если перевести их в простую математическую форму. Уравнение Михаэлиса-Ментен представляет собой алгебраическое выражение гиперболической формы таких кривых. Членами этого важнейшего уравнения являются: концентрация субстрата S, начальная скорость ʋ0, Vmax и Км. Уравнение Михаэлиса- Ментен лежит в основе всех кинетических исследований ферментативных реакций, так как оно позволяет рассчитывать количественные характеристики ферментов и проводить анализ их ингибирования.
Теперь мы рассмотрим подробнее основные логические и алгебраические этапы, через которые проходит вывод уравнения Михаэлиса— Ментен на современном уровне. Прежде всего напишем две основные реакции образования и распада фермент-субстратного комплекса
 |
Введем следующие обозначения: [Et]-общая концентрация фермента (суммарное количество свободного и связанного фермента), [ES] - концентрация фермент-субстратного комплекса и [Еt] — [ES] - концентрация свободного, т. е. несвязанного, фермента. Поскольку концентрация субстрата [S] обычно гораздо больше, чем [Et], количество субстрата S, связанного с ферментом Е в любой момент времени, можно считать пренебрежимо малым по сравнению с общим количеством субстрата S. Вывод уравнения начинается с определения скоростей образования и распада фермент-субстратного комплекса ES.
1. Скорость образования ES. Скорость образования ES в реакции (а)
равна

где к1 - константа скорости реакции (а). Скорость образования ES из Е + Р в обратной реакции (б) очень мала по сравнению со скоростью прямой реакции и поэтому ею можно пренебречь.
2. Скорость распада ES. Скорость распада ES равна
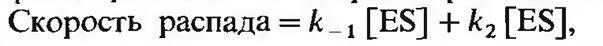
где к-1 и к2- константы скорости соответственно обратной реакции (а) и прямой реакции (б).
3.
 |
Стационарное состояние. Когда скорость образования фермент-
субстратного комплекса ES равна скорости его распада, концентрация ES постоянна, и реакция протекает в стационарном режиме:
4. Разделение констант скоростей. Преобразование левой части урав-
нения (г) дает

При упрощении его правой части получаем  .
.
 |
Следовательно,
Если перенести член-  в правую часть уравнения и изменить его знак, то получим
в правую часть уравнения и изменить его знак, то получим
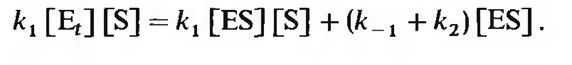 |
Дальнейшее упрощение дает

 |
Теперь мы можем решить это уравнение относительно [ES]
Это уравнение можно упростить, объединив константы скоростей в одном уравнении:
гряп
 |
5. Определение начальной скорости v0 через [ES] Согласно теории Михаэлиса-Ментен, начальная скорость определяется как скорость распада фермент-субстратного комплекса, т. е. скорость реакции (б), константа скорости которой равна к2. Таким образом, мы можем написать
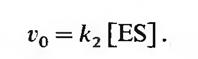 |
 Поскольку, однако, величина [ES] равна правой части уравнения (д), мы имеем:
Поскольку, однако, величина [ES] равна правой части уравнения (д), мы имеем:
Полученное уравнение можно упростить, если  обозначить через Км (константа Михаэлиса-Ментен), а к2 [Еt]- через Vmax*Vmax -это максимальная скорость реакции, наблюдаемая в условиях, когда весь фермент Е находится в форме фермент-субстратного комплекса ES. Подставив эти две величины в уравнение (е), получим:
обозначить через Км (константа Михаэлиса-Ментен), а к2 [Еt]- через Vmax*Vmax -это максимальная скорость реакции, наблюдаемая в условиях, когда весь фермент Е находится в форме фермент-субстратного комплекса ES. Подставив эти две величины в уравнение (е), получим:
 |
Это и есть уравнение Михаэлиса-Ментен, т.е. уравнение скорости односубстратной ферментативной реакции. Оно выражает количественное соотношение между начальной скоростью реакции v0, максимальной скоростью реакции Vmax и исходной концентрацией субстрата, связанных между собой через константу Михаэлиса-Ментен Км.
В специальном случае, когда начальная скорость реакции в точности равна половине максимальной скорости, т.е. когда 
(рис. 9-4), можно, исходя из уравнения Михаэлиса-Ментен, получить важное численное соотношение:
 |
Если разделить обе части этого уравнения на Vmax, то будем иметь

Решая это уравнение относительно Км, получаем:
КМ + [S] = 2[S]
Км = [S] (при условии, что v0 точно равно 1/2Vmax)
Уравнение Михаэлиса-Ментен можно преобразовать алгебраическим способом и выразить в виде ряда эквивалентных уравнений, которые полезны для практического определения величин Км и Vmax и используются также при изучении действия ингибиторов.
Теория Михаэлиса-Ментен позволяет количественно описать большинство ферментативных реакций, включая реакции с участием двух или более субстратов. Это служит еще одним убедительным подтверждением того, что ферменты катализируют реакции, временно присоединяясь к своим субстратам, в результате чего снижается энергия активации всей реакции в целом. Образование фермент-субстратных комплексов можно доказать с помощью прямых физико- химических методов, например по характерным изменениям спектра поглощения фермента при добавлении субстрата.
Преобразование уравнения Михаэлиса-Ментен: график в двойных обратных координатах
Уравнение Михаэлиса - Ментен
 |
можно преобразовать алгебраическим способом в другие формы, более удобные для анализа экспериментальных данных. Одно часто применяемое преобразование состоит просто в том, что обе части уравнения Михаэлиса-Ментен (а) выражают в виде обратных величин
 |
Разделив числитель в правой части уравнения на его составляющие, получаем
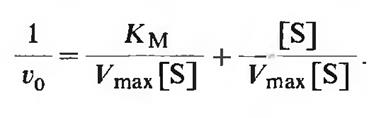 |
Упрощение этого уравнения дает
 |
 |
Уравнение (б), представляющее собой преобразованное уравнение Михаэлиса - Ментен, называется уравнением Лайнуивера - Бэрка. Для ферментов, строго подчиняющихся кинетике Михаэлиса - Ментен, зависимость 1 /v0 от 1[S] выражается прямой линией (рис.3).
Тангенс угла наклона этой линии численно равен величине Км/Vmax, отрезок, отсекаемый на оси ординат,-величине 1/Vmax, а отрезок, отсекаемый на оси абсцисс,- 1 /Км- График, построенный в двойных обратных координатах (график Лайнуивера - Бэрка) имеет то преимущество, что позволяет более точно определить величину Vmах, которая на графике зависимости v0 от [S] может быть лишь аппроксимирована (как показано на рис. 4). Существуют и другие способы преобразования уравнения Михаэлиса - Ментен. Каждый из них имеет свои преимущества при исследовании кинетики ферментативных реакций.
Как мы увидим дальше, графики в двойных обратных координатах с большой пользой применяются также при изучении ингибирования ферментативных реакций.
Величина Kм-это ключевой пункт уравнения Михаэлиса-Ментен. Она характеризует поведение данного фермента по отношению к тому или иному субстрату при определенных значениях температуры и рН. Приблизительное значение Kм можно получить простым графическим способом, как показано на рис.2 Однако из кривой такого типа трудно определить точно величину Vmах, поскольку эта величина соответствует точке, к которой стремится кривая, но которую она никогда не достигнет. Используя алгебраические преобразования уравнения Михаэлиса-Ментен можно получить более точное значение Kм из графика, построенного по тем же данным, но в других координатах, называемых двойными обратными координатами.
Ферменты, имеющие два или более субстрата, такие, как гексокиназа или аспартатаминотрансфераза, катализирующая обратимую реакцию
 |
могут иметь различные значения Км для разных субстратов.
В тех условиях, которые существуют в клетке, ферменты обычно не насыщены субстратом и, значит, функционируют, как правило, не с максимально возможными скоростями. Изменяя внутриклеточные концентрации субстратов, можно в какой-то степени регулировать скорость ферментативных реакций в клетке.