Углерод - малоактивен, на холоде реагирует только с фтором; химическая активность проявляется при высоких температурах.
Восстановительные свойства проявляются при взаимодействии:
· с кислородом:
t
C + O2 → CO2;
- при недостатке кислорода наблюдается неполное сгорание:
t
2C + O2 → 2C+2O (угарный газ);
· с фтором: С + 2F2 → CF4;
· с водяным паром:
C + H2O –1200ºC→С+2O + H2 (водяной газ);
· с оксидами металлов:
C + 2CuO –tºC→ 2Cu + C+4O2;
· с кислотами – окислителями:
C + 2H2SO4(конц.) → С+4O2 + 2SO2 + 2H2O;
С + 4HNO3(конц.) → С+4O2 + 4NO2 + 2H2O
Окислительные свойства углерода подтверждают реакции:
· с металлами, в результате которых образуются карбиды:
4Al + 3C → Al4C3; Ca + 2C→ CaC2 - 4;
· с водородом: C + 2H2 → CH4
2.3.5. Оксид углерода (II) - CO
Угарный газ: бесцветный, без запаха, малорастворим в воде, растворим в органических растворителях, ядовит, tкип = –192ºC;
t пл. = –205ºC.
Получение
· в промышленности (в газогенераторах):
C + O2 ® CO2; CO2 + C ® 2CO;
· в лаборатории - термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH ® H2O + CO; H2C2O4 ® CO + CO2 + H2O
Химические свойства
При обычных условиях CO инертен; при нагревании проявляет восстановительные свойства восстановитель; относится к несолеобразующим оксидам.
Взаимодействует:
· с кислородом: 2C+2O + O2 → 2C+4O2;
· с оксидами металлов: C+2O + CuO → Сu + C+4O2;
· с хлором (на свету): CO + Cl2 –hν→ COCl2 (фосген);
· с переходными металлами образует карбонилы:
Ni + 4CO –tºC→ Ni(CO)4; Fe + 5CO –tºC→ Fe(CO)5
2.3.6. Оксид углерода (IV) СO2
Углекислый газ: бесцветный, без запаха, растворимость в воде - в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха;
t пл.= -78,5ºC (твёрдый CO2 называется "сухой лёд"); не поддерживает горение. В воздухе содержится % СО2.
| Структурная формула: | O=C=O |
Получение СO2:
· термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка:
CaCO3 –tº→ CaO + CO2;
· действием сильных кислот на карбонаты и гидрокарбонаты:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 ;
NaHCO3 + HCl → NaCl + H2O + CO2;
Химические свойства
· СO2 - кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
Na2O + CO2 → Na2CO3; 2NaOH + CO2 → Na2CO3 + H2O;
NaOH + CO2 → NaHCO3;
· при повышенной температуре может проявлять окислительные свойства:
С+4O2 + 2Mg –tº→ 2Mg+2O + C0
Угольная кислота и её соли
Структурна формула угольной кислоты H2CO3:
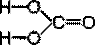
Угольная кислота неустойчива, существует только в водном растворе: CO2 + H2O ↔ H2CO3
H2CO3 – двухосновная кислота, являющаяся слабым электролитом. Диссоциации ее протекает в две ступени:
I. H2CO3 ↔ H+ + HCO3 - К1 = 4,41 * 10-7;
II. HCO3 - ↔ H+ + CO32 - К2 = 5,61 * 10-11
Для нее характерны все свойства кислот. Образует средние соли карбонаты (СO32-) и кислые соли - гидрокарбонаты (HCO3 -).
Карбонаты и гидрокарбонаты могут превращаться друг в друга:
2NaHCO3 –tº→ Na2CO3 + H2O + CO2;
Na2CO3 + H2O + CO2 → 2NaHCO3.
Карбонаты металлов (кроме щелочных металлов) при нагревании разлагаются с образованием оксида:
CuCO3 – tº→ CuO + CO2
Качественная реакция - "вскипание" при действии сильной кислоты:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2 ↑; CO32- + 2H+ → H2O + CO2 ↑
КРЕМНИЙ
Открыт Ж. Гей-Люссаком и Л.Тенаром в 1811г. Второй по распространённости элемент в земной коре (27,6% по массе). Электронная формула: 1s22s22p6 3s23p2. Степени окисления в соединениях: + 4, - 4. Соединения кремния являются основой многих силикатных и алюмосиликатных минералов.
Аллотропия
Кристаллический – тёмно-серое вещество с металлическим блеском, имеет большую твёрдость, хрупок, проявляет полупроводниковые свойства; ρ = 2,33 г/см3, t°пл. =1415°C; t°кип. = 2680°C. Имеет алмазоподобную структуру (sp3- гибридизация атомов кремния). Инертен.
Аморфный - бурый порошок, гигроскопичен, также имееталмазоподобная структура, r = 2 г/см3, более реакционноспособен.
Получение:
· карботермическим способом: 2С + Si+4O2 –tº→ Si0 + 2CO;
· магнийтермическим способом: 2Mg + Si+4O2 –tº→ 2MgO + Si0
Химические свойства
· Типичный неметалл, инертен.
· Как восстановитель реагирует:
а) с кислородом: Si0 + O2 –tº→ Si+4O2;
б) с фтором (без нагревания): Si0 + 2F2 ® SiF4↑;
в) с углеродом: Si0 + C –tº→ Si+4C
(SiC - карборунд – твёрдый; используется для точки и шлифовки);
· с водородом не взаимодействует. Силан (SiH4) получают разложением силицидов металлов кислотой:
Mg2Si + 2H2SO4 ® SiH4↑ + 2MgSO4;
· с кислотами не реагирует. Растворяется только в смеси азотной и плавиковой кислот:
3Si + 4HNO3 + 18HF → 3H2 [SiF6] + 4NO + 8H2O;
· со щелочами реакция протекает при нагревании:
Si0 + 2NaOH + H2O –tº→ Na2Si+4O3+ 2H2;
· как окислитель взаимодействует с металлами (образуются силициды):
Si0 + 2Mg –tº→ Mg2Si-4.
2.4.1. Силан SiH4
Бесцветный газ, ядовит, t пл. = -185ºC, tкип. = -112ºC.
Получение
Получают силан действием соляной кислоты на силицид магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Химические свойства
· силан окисляется кислородом:
SiH4 + 2O2 → SiO2 + 2H2O;
· разлагается: SiH4 → Si + 2H2
2.4.2. Оксид кремния (IV) (SiO2)n
SiO2 - кварц, горный хрусталь, аметист, агат, яшма, опал, кремнозём (основная часть песка)

Al2O3 • 2SiO2 • 2H2O - каолинит (основная часть глины)
K2O • Al2O3 • 6SiO2 - ортоклаз (полевой шпат)
Физические свойства
Твёрдое, тугоплавкое вещество, tпл.= 1728ºC, tкип.= 2590ºC
SiO2 – кислотный оксид
При сплавлении взаимодействует с основными оксидами, щелочами, а также с карбонатами щелочных и щелочноземельных металлов:
· с основными оксидами:
SiO2 + CaO → CaSiO3;
· со щелочами: SiO2 + 2NaOH → Na2SiO3 + H2O;
· с солями: SiO2 + CaCO3 –tº→ CaSiO3 + CO2;
SiO2 + K2CO3 –tº→ K2SiO3 + CO2;
· с плавиковой кислотой:
SiO2 + 4HF → SiF4 + 2H2O;
SiO2 + 6HF → H2 [SiF6] (гексафторкремниевая кислота) + 2H2O
(реакции лежат в основе процесса травления стекла).
Оксид кремния не растворяется в воде.
Кремниевые кислоты

x SiO2 * y H2O
x = 1, y = 1 H2SiO3 - метакремниевая кислота;
x = 1, y = 2 H4SiO4 - ортокремниевая кислота и т.д.
H2SiO3 - очень слабая (слабее угольной), непрочная, в воде малорастворима (образует коллоидный раствор), не имеет кислого вкуса.
Получение
Так как оксид кремния нерастворим в воде, то кремниевую кислоту получают реакцией обмена:
Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓
При нагревании она разлагается:
H2SiO3 –tº→ H2O + SiO2.
Отмытый и высушенный гель кремниевой кислоты называется силикагелем. Соли кремниевой кислоты - силикаты.
ПОДГРУППА V-A
Общая характеристика элементов главной подгруппы V группы
(подгруппы азота)
Таблица. Электронное строение и физические свойства
| Поряд- ковый № | Элемент | Электронная конфигурация | Атомный радиус, нм | ЭО | Степени окисления |
| Азот (N) | [He] 2s22p3 | 0,075 | 3,0 | -3, -2, -1, +1, +2, +3, +4, +5 | |
| Фосфор (P) | [Ne] 3s23p3 | 0,110 | 2,1 | -3, +1, +3, +5 | |
| Мышьяк (As) | [Ar] 3d104s24p3 | 0,121 | 2,0 | -3, +3, +5 | |
| Сурьма (Sb) | [Kr] 4d105s25p3 | 0,141 | 1,9 | -3, +3, +4, +5 | |
| Висмут (Bi) | [Xe] 4f145d106s26p3 | 0,152 | 1,9 | +3, +5 |
В ряду –N – P – As – Sb – Bi увеличиваются размеры атомов, ослабляется притяжение валентных электронов к ядру, ослабляются неметаллические свойства, возрастают металлические свойства, ЭО уменьшается.
N, P - типичные неметаллы; As, Sb - проявляют неметаллические и металлические свойства; Bi - типичный металл.
P, As и Bi существуют в твердом состоянии в нескольких модификациях.
Химические свойства
· Основный характер оксидов R2O5 увеличивается, а кислотный – ослабевает с увеличением порядкового номера;
· Гидроксиды всех элементов в степени окисления (+5) имеют кислотный характер;
· Основный характер гидроксидов R(OH)3 увеличивается, а кислотный – ослабевает с увеличением порядкового номера:
RO33- + 3H+ ↔ R(OH)3 ↔ R3+ + 3OH - (R – элемент).
· As, Sb, и Bi плохо растворимы в воде.
· Восстановительные свойства водородных соединений RH3 усиливаются, а устойчивость уменьшается с увеличением порядкового номера.
АЗОТ
:N≡N:
Открыт Д.Резерфордом в 1772 г. Основной компонент воздуха (78% по объему, 75,6% по массе). В молекуле имеются одна σ- и две π- связи.
Получение
· Промышленный способ. Перегонка жидкого воздуха.
· Лабораторный способ. Разложение нитрита аммония:
NH4NO2 –tº→ N2 + 2H2O
Химические свойства
Молекула N2 очень устойчива (три ковалентные связи), поэтому обладает низкой реакционной способностью, однако при особых условиях может проявлять как восстановительные, так и окислительные свойства, так как находится в промежуточной степени окисления.
· Восстановительные свойства проявляются при высокой температуре (электрическая дуга, 3000ºС):
N20 + O2 → 2N+2O
(в природе - во время грозы);
· Окислителем азот является в реакциях взаимодействия:
а) c водородом (500º С, катализатор - P):
N20 + 3H2 ↔ 2N-3HЗ;
б) с активными металлами (со щелочными и щелочно-земельными металлами):
6Li + N20 → 2LiЗN-3; 3Mg + N20 –tº→ MgЗN2-3
2.5.2. АММИАК (NH3)
Строение
Молекула полярная, имеет форму треугольной пирамиды с атомом азота в вершине, ∟HNH = 107,3º. Атом азота находится в sp3- гибридном состоянии; из четырех гибридных орбиталей азота три участвуют в образовании одинарных связей N–H, а четвертая связь занята неподеленной электронной парой.

Азот в аммиаке находится в степени окисления -3.
Химические свойства
Образование ковалентной связи по донорно-акцепторному механизму представлено на схеме:
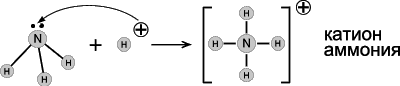
· Аммиак - основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус – синий; фенолфталеин – малиновый) из-за образования гидроксида аммония:
NH3 + Н2O ↔ NH4OH ↔ NH4+ + OH-.
· Аммиак реагирует с кислотами с образованием солей аммония:
NH3 + HCl → NH4Cl; NH3 + H2O + CO2 → NH4HCO3;
· Аммиак проявляет восстановительные свойства (окисляется до N2+1O или N+2O);
· При нагревании разлагается:
2N-3H3 –tº→ N20 + 3H2;
· Горит в кислороде: a) без катализатора 4N-3H3 + 3O2 → 2N20 + 6Н2O;
б) в присутствии катализатора Pt: 4N-3H3 + 5O2 → 4N+2O + 6Н2O;
· Восстанавливает оксиды некоторых металлов:
3Cu+2O + 2N-3H3 → 3Cu0 + N20 + 3Н2O
ОКСИДЫАЗОТА
| N2+1O оксид азота (I) закись азота, "веселящий газ" N+2O оксид азота (II) окись азота N2+3O3 оксид азота (III) азотистый ангидрид | N+4O2 оксид азота (IV) двуокись азота, диоксид азота N2+5O5 оксид азота (V) азотный ангидрид |
АЗОТИСТАЯ КИСЛОТА
HNO2 – Азотистая кислота H–O–N=O
Физические свойства
Существует только в разбавленных водных растворах.
Получение
Получают действием соляной кислоты на нитриты металлов:
AgNO2 + HCl → HNO2 + AgCl↓
Химические свойства
· Азотистая кислота является слабым электролитом. Диссоциирует в водном растворе незначительно: HNO2 ↔ H+ + NO2 -; Кд = 4 * 10-4
· ее соли (нитриты) – устойчивы:
HNO2 + NaOH → NaNO2 + H2O;
· Разлагается при нагревании:
3HNO2 → HNO3 + 2NO↑ + H2O;
· NO2- _ слабый окислитель (окислительные свойства проявляет только в реакциях с сильными восстановителями):
2KNO2 + 2KI + 2H2SO4 → 2K2SO4 + I2 + 2NO + 2H2O
| 2I- - 2ē → I20 | |
| NO2- + 2H+ + 1ē → NO + H2O |
2I- + 2NO2- + 4H+ → I20 + 2NO + 2H2O
· HNO2 - сильный восстановитель:
HNO2 + Cl2 + H2O → HNO3 + 2HCl
2Cl0 + 2ē → 2Cl-
HNO2 ─ 2ē + H2O → NO3─ + 3H+
HNO2 + Cl2 + H2O → NO3─ + 2Cl- + 3H+
АЗОТНАЯ КИСЛОТА
HNO3 – Азотная кислота
 или
или
 O O
 H – O – N
O H – O – N
O
|
Физические свойства
Бесцветная жидкость, неограниченно растворимая в воде; tпл.= - 41ºC;
Tкип = 82,6ºС, ρ = 1,52 г/см3
Получение
· Лабораторный способ:
KNO3 + H2SO4(конц) –tº→ KHSO4 + HNO3↑;
· Промышленный способ. Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO:
4NH3 + 5O2 –500ºC, Pt→ 4NO + 6H2O;
б) Окисление кислородом воздуха NO до NO2:
2NO + O2 → 2NO2;
c) Поглощение NO2 водой в присутствии избытка кислорода:
4NO2 + О2 + 2H2O ↔ 4HNO3
Химические свойства
Азотная кислота является очень сильным электролитом. Диссоциирует в водном растворе практически нацело: HNO3 → H+ + NO3 -.
Реагирует:
· с основными оксидами:
CuO + 2HNO3 → Cu(NO3)2 + H2O; CuO + 2H+ → Cu2+ + H2O;
· с основаниями: HNO3 + NaOH → NaNO3 + H2O; H+ + OH - → H2O;
· вытесняет слабые кислоты из их солей:
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2↑
2H+ + СO32 - → H2O + CO2↑
Азотная кислота - сильный окислитель:
· Разлагается на свету и при нагревании:
4HNO3 –tºC, hν→ 2H2O + 4NO2↑ + O2↑:
· Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция");
· При взаимодействии с металлами никогда не выделяется водород (см. метод. разработку часть I):
металл + HNO3разб. → соль азотной кислоты + вода + газ (N2, N2O, NO, или NH4+ в зависимости от активности металла);
металл + HNO3конц.→ соль азотной кислоты + вода + NO2 (независимо от активности металла)
· С неметаллами:
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O;
B0 + 3HNO3 → H3B+3O3 + 3NO2;
3P0 + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
ФОСФОР И ЕГО СОЕДИНЕНИЯ
Фосфор (P) - открыт алхимиком Х. Брандом в 1669 году. В свободном состоянии в природе не встречается. Электронная конфигурация 1S22S22P6 3S23P3. Высшая положительная степень окисления фосфора в соединениях равна (+5), низшая – (-3).
Химические свойства
Фосфор реагирует:
· С кислородом с образованием оксида Р(V):
4P0 + 5O2 –tºC→ 2P2+5O5;
(при недостатке кислорода: 4P0 + 3O2 –tºC→ 2P2+3O3);
· С галогенами и серой: 2P + 3Cl2 → 2PCl3;
2P + 5Cl2 → 2PCl5; 2P + 5S –tºC→ P2S5;
· С азотной кислотой:
3P0 + 5HN+5O3 + 2H2O → 3H3P+5O4 + 5N+2O↑;
· С металлами образует фосфиды, в которых фосфор проявляет степень окисления - 3:
2P0 + 3Mg → Mg3P2-3;
(фосфид магния легко разлагается водой):
Mg3P2 + 6H2O → 3Mg(OH)2 + 2PH3↑(фосфин));
3Li + P → Li3P-3
· С раствором щелочи:
4P + 3NaOH + 3H2O → PH3 + 3NaH2PO2
(Реакция диспропорционирования)
P2+3 O3 - фосфористый ангидрид (оксид фосфора (III)).
Белые кристаллы, t°пл.= 24° С; t°кип.= 175°C. Существует в виде нескольких модификаций. В парах состоит из молекул P4O6. P2O3 соответствует фосфористая кислота H3PO3.
Получение: Окисление фосфора при недостатке кислорода:
4P + 3O2 → 2P2O3
Химические свойства
Для P2O3 характерны все свойства кислотных оксидов. Оксид фосфора (III) растворяется в воде с образованием фосфористой кислоты, являющейся слабым электролитом: P2O3 + 3H2O → 2H3PO3.
Является сильным восстановителем и при взаимодействии с кислородом образует оксид фосфора (V): O2+ P2+3O3 → P2+5O5
P2+5O5 - фосфорный ангидрид (оксид фосфора (V)).
Белые кристаллы, tпл.= 570º С, tкип.= 600ºC, ρ = 2,7 г/см3. Имеет несколько модификаций. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение:
4P + 5O2 → 2P2O5
Химические свойства
Оксид фосфора (V), проявляя кислотные свойства: реагирует с водой, основными оксидами и щелочами:
· P2O5 + H2O → 2HPO3(метафосфорная кислота);
P2O5 + 2H2O → H4P2O7(пирофосфорная кислота);
P2O5 + 3H2O → 2H3PO4(ортофосфорная кислота);
· P2O5 + 3BaO → Ba3(PO4)2;
P2O5 + 6KOH → 2K3PO4+ 3H2O
· P2O5 - сильное водоотнимающее средство:
P2O5+ 2HNO3 → 2HPO3 + N2O5;
P2O5+ 2HClO4 → 2HPO3+ Cl2O7
HP+5O3 - Метафосфорная кислота

Получение
P2O5+ H2O → 2HPO3
Соли метафосфорной кислоты - метафосфаты (KPO3 – метафосфат калия)
Химические свойства
Характерны все свойства кислот.
H3P+5O3 Фосфористая кислота

Бесцветное кристаллическое вещество; tпл.= 74ºС, хорошо растворимое в воде.
Получение
PCl3+ 3H2O → H3PO3+ 3HCl
Химические свойства
· Водный раствор H3PO3 - двухосновная кислота средней силы (соли – фосфиты):
H3PO3+ 2NaOH → Na2HPO3+ 2H2O;
· При нагревании превращается в ортофосфорную кислоту и фосфин:
4H3PO3 → 3H3PO4+ PH3;
· Проявляет восстановительные свойства:
H3PO3+ HgCl2+ H2O → H3PO4+ Hg + 2HCl
H3P+5O4 Ортофосфорная кислота

Белое твердое вещество, гигроскопичное, хорошо растворимое в воде; tпл.= 42ºС, ρ= 1,88 г/см3.
Диссоциация:
H3PO4 ↔ H+ + H2PO4-
H2PO4- ↔ H+ + HPO42-
HPO42- ↔ H+ + PO43-
Ортофосфорная кислота – кислота трехосновная средней силы. Она образует средние соли - ортофосфаты (Na3PO4) и два типа кислых солей - дигидрофосфаты (NaH2PO4) и гидрофосфаты (Na2HPO4).
Получение
· Растворением фосфорного ангидрида в воде: P2O5+ 3H2O → 2H3PO4;
· Промышленный способ:
а) Взаимодействием ортофосфатат кальция с серной кислотой: Ca3(PO4)2(твердый) + 3H2SO4(конц.) → 2H3PO4 + 3CaSO4↓;
б) Растворением фосфора в азотной кислоте:
3P + 5HNO3+ 2H2O → 3H3PO4+ 5NO↑
Химические свойства
Для ортофосфорной кислоты характерны все свойства кислот – неокислителей. При нагревании она превращается в пирофосфорную кислоту.
2H3PO4 –tº→ H4P2O7 + H2O
Качественная реакция на обнаружение в растворе анионов PO43 - :
3Ag+ + PO43- → Ag3PO4↓(ярко-желтый осадок)
ОБЩАЯ ХАРАКТЕРИСТИКА
ЭЛЕМЕНТОВ ГЛАВНОЙ ПОДГРУППЫVI ГРУППЫ
Электронное строение и физические свойства.
| Поряд- ковый № | Элемент | Относитель- ная атомная масса | Электронная конфигурация | Атомный радиус, нм | ПИ эВ | Э.О | Степени окисления |
| Кислород (O) | 15,9994 | [He] 2s22p4 | 0,066 | 14,5 | 3,5 | -2, -1, +1, +2 | |
| Сера (S) | 32,06 | [Ne] 3s23p4 | 0,105 | 10,5 | 2,6 | -2, +2, +3, +4, +5, +6 | |
| Селен (Se) | 78,96 | [Ar] 3d104s24p4 | 0,116 | 9,8 | 2,01 | -2, +4, +6 | |
| Теллур (Te) | 127,60 | [Kr] 4d105s25p4 | 0,143 | 8,6 | 1,9 | -3, +3, +4, +5 | |
| Полоний (Po) | 208,98 | [Xe] 4f145d106s26p4 | 0,176 | 7,8 | 1,76 | +2, +4 |
КИСЛОРОД
Самый распространенный элемент на Земле; в воздухе - 21% по объему; в земной коре - 49% по массе; в гидросфере - 89% по массе; в составе живых организмов-- до 65% по массе.
Способы получения
· Промышленный способ (перегонка жидкого воздуха).
· Лабораторный способ (разложение некоторых кислородосодержащих веществ):
2KMnO4 –tº→ K2MnO4 + MnO2 + O2↑;
2KClO3 –t_;MnO2→ 2KCl + 3O2↑;
2H2O2 –MnO2→ 2H2O + O2↑
Химические свойства
Взаимодействие веществ с кислородом называется окислением.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия с фтором) кислород является окислителем.
Кислород взаимодействует:
· с неметаллами: C + O2 → CO2; S + O2 → SO2;
2H2 + O2 → 2H2O
· с металлами: 2Mg + O2 → 2MgO;
2Cu + O2 –tº→ 2CuO
· со сложными веществами: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2;
2H2S + 3O2 → 2SO2 + 2H2O; CH4 + 2O2 → CO2 + 2H2O
ОЗОН O3
Озон - аллотропная модификация кислорода.
Получение:
3O2 → 2O3
· Во время грозы (в природе), (в лаборатории) в озонаторе;
· Действием серной кислоты на пероксид бария:
3BaO2 + 3H2SO4 → 3BaSO4 + 3H2O + O3↑
Химические свойства
· Неустойчив: O3 → O2 + O;
· Сильный окислитель:
2KI + O3 + H2O → 2KOH + I2 + O2
Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает микроорганизмы.
СЕРА
Физические свойства
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), tкип = 445º С.
Получение
· Промышленный метод - выплавление из руды с помощью водяного пара.
· Неполное окисление сероводорода (при недостатке кислорода):
2H2S + O2 → 2S + 2H2O
· Реакция Вакенродера: 2H2S + SO2 → 3S + 2H2O
Химические свойства
Окислительные свойства серы
(S0 + 2ē → S-2)
· Сера реагирует со щелочными металлами без нагревания:
2Na + S → Na2S;
· c остальными металлами (кроме Au, Pt) - при повышенной t:
2Al + 3S –tº→ Al2S3; Zn + S –tº→ ZnS;
· с некоторыми неметаллами сера образует бинарные соединения:
H2 + S → H2S; 2P + 3S → P2S3; C + 2S → CS2
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
(S - 2ē → S+2; S - 4ē → S+4; S - 6ē → S+6)
· c кислородом: S + O2 –tº→ S+4O2; 2S + 3O2 –tº; pt→ 2S+6O3;
· c галогенами (кроме йода):
S + Cl2 → S+2Cl2
· c кислотами - окислителями:
S + 2H2SO4(конц) → 3S+4O2 + 2H2O;
S + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
· Реакции диспропорционирования:
3S0 + 6KOH → K2S+4O3 + 2K2S-2 + 3H2O;
· сера растворяется в концентрированном растворе сульфита натрия:
S0 + Na2S+4O3 → Na2S2O3 тиосульфат натрия

СЕРОВОДОРОД

Получение:
· взаимодействием с водородом:
H2 + S ←tº→ H2S;
· действием соляной кислоты на сульфид железа (11):
FeS + 2HCl → FeCl2 + H2S↑
Химические свойства
· Раствор H2S в воде – слабая двухосновная кислота:
H2S ↔ H+ + HS -; HS - ↔ H+ + S2-;
K1 = ([H+] • [HS-]) / [H2S] = 1 • 10-7;
K2 = ([H+] • [S2-]) / [HS - ] = 1,3 • 10-14
Сероводородная кислота образует два ряда солей - средние (сульфиды) и кислые (гидросульфиды).
· Взаимодействует с основаниями:
H2S + 2NaOH → Na2S + 2H2O;
· H2S проявляет очень сильные восстановительные свойства:
H2S-2 + Br2 → S0 + 2HBr;
H2S-2 + 2FeCl3 → 2FeCl2 + S0 + 2HCl;
H2S-2 + 4Cl2 + 4H2O → H2S+6O4 + 8HCl;
3H2S-2 + 8HNO3 (конц) → 3H2S+6O4 + 8NO + 4H2O;
H2S-2 + H2S+6O4 (конц) → S0 + S+4O2 + 2H2O;
(при нагревании реакция идет по - иному:
H2S-2 + 3H2S+6O4 (конц) –t°→ 4S+4O2 + 4H2O)
· Сероводород окисляется:
при недостатке O2: 2H2S-2 + O2 → 2S0 + 2H2O;
при избытке O2: 2H2S-2 + 3O2 → 2S+4O2 + 2H2O;
· Серебро при контакте с сероводородом чернеет:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O;
· Качественная реакция на сероводород и растворимые сульфиды - образование темно-коричневого (почти черного) осадка PbS:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3;
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3; Pb2+ + S2 - → PbS↓
Одной из основных причин потемнения художественных картин старых мастеров было использование свинцовых белил, которые за несколько веков, взаимодействуя со следами сероводорода в воздухе (образуются в небольших количествах при гниении белков; в атмосфере промышленных регионов и др.) превращаются в PbS.
· Реставрация: PbS + 4H2O2 → PbSO4(белый) + 4H2O
Сульфиды
· Растворимые сульфиды сильно гидролизованы, вследствие чего их водные растворы имеют щелочную реакцию:
K2S + H2O ↔ KHS + KOH; S2- + H2O ↔ HS- + OH-;
· Сульфиды металлов, стоящих в ряду напряжений левее железа(включительно), растворимы в сильных кислотах:
ZnS + H2SO4 →ZnSO4 + H2S↑; HgS + H2SO4 ≠
Нерастворимые сульфиды можно перевести в растворимое состояние действием концентрированной HNO3:
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O;
· Водорастворимые сульфиды растворяют серу с образованием полисульфидов: Na2S + nS → Na2Sn+1 (1 < n < 5).
Полисульфиды при окислении превращаются в тиосульфаты, например: 2Na2S2 + 3O2 → 2Na2S2O3
На различной растворимости сульфидов и различной окраске многих из них основан качественный анализ катионов.
ОКСИДЫСЕРЫ
Оксид серы IV
SO2 (сернистый ангидрид; сернистый газ)

Физические свойства
Бесцветный газ с резким запахом; хорошо растворим в воде (в 1V H2O растворяется 40V SO2 при н.у.); tпл. = – 75,5ºC; tкип. = – 10ºС. Обесцвечивает многие красители, убивает микроорганизмы.
Получение
· При сжигании серы в кислороде: S + O2 → SO2;
· 2) Окислением сульфидов: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑;
· Обработкой солей сернистой кислоты минеральными кислотами:
Na2SO3 + 2HCl → 2NaCl + SO2↑ + H2O;
· При окислении металлов концентрированной серной кислотой:
Cu + 2H2SO4(конц) → CuSO4 + SO2↑ + 2H2O
Химические свойства
· Сернистый ангидрид - кислотный оксид. При растворении в воде образуется слабая и неустойчивая сернистая кислота H2SO3 (существует только в водном растворе):
SO2 + H2O ↔ H2SO3; H2SO3 ←K1→ H+ + HSO3 -; HSO3 - ←K2→ 2H+ + SO32 -;
K1 = ([H+] · [HSO3-]) / [H2SO3] = 1,6 · 10 - 2
H2SO3 образует два ряда солей - средние (сульфиты) и кислые (бисульфиты, гидросульфиты):
Ba(OH)2 + SO2 → BaSO3↓(сульфит бария) + H2O;
Ba(OH)2 + 2SO2 → Ba(HSO3)2(гидросульфит бария);
· Реакции окисления (S+4 – 2ē → S+6);
SO2 + Br2 + 2H2O → H2SO4 + 2HBr;
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
Водные растворы сульфитов щелочных металлов окисляются на воздухе:
2Na2SO3 + O2 → 2Na2SO4; 2SO32 - + O2 → 2SO42 -;
· Реакции восстановления (S+4 + 4ē → S0): SO2 + С –t°→ S + СO2;
SO2 + 2H2S → 3S + 2H2O
Оксид серы VI
SO3 (серный ангидрид)

Физические свойства
Бесцветная летучая жидкость, tпл. = 17ºC; tкип. = 66º С; на воздухе "дымит", сильно поглощает влагу (хранят в запаянных сосудах):
SO3 + H2O → H2SO4
Твердый SO3 существует в трех модификациях. SO3 хорошо растворяется в 100%-ной серной кислоте, этот раствор называется олеумом.
Получение
· Окисление SO2: 2SO2 + O2 –кат; 450°C→ 2SO3;
· Термическое разложение сульфата железа (111):
Fe2(SO4)3 –t°→ Fe2O3 + 3SO3↑
Химические свойства
· Серный ангидрид - кислотный оксид. При растворении в воде дает сильную двухосновную серную кислоту:
SO3 + H2O → H2SO4; H2SO4 → H+ + HSO4 - ; HSO4 - ↔ 2H+ + SO42 -.
H2SO4 образует два ряда солей - средние (сульфаты) и кислые (гидросульфаты): 2NaOH + SO3 → Na2SO4 + H2O; NaOH + SO3 → NaHSO4;
· SO3 – сильный окислитель.
СЕРНАЯ КИСЛОТА
H2SO4

Физические свойства
Тяжелая маслянистая жидкость ("купоросное масло"); ρ= 1,84 г/см3; нелетучая, хорошо растворима в воде – с сильным нагревом; tпл. = 10,3ºC,
tкип. = 296ºС, очень гигроскопична, обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара).
Помните!
Кислоту вливать малыми порциями в воду, а не наоборот!
Химические свойства
H2SO4 - сильная двухосновная кислота.
Взаимодействует:
· с металлами:
a) разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn0 + H2+1SO4(разб) → Zn+2SO4 + H20↑
б) концентрированная H2+6SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или H2S - 2 (без нагревания не реагируют также Fe, Al, Cr - пассивируются):
2Ag0 + 2H2+6SO4 → Ag2+1SO4 + S+4O2↑ + 2H2O;
8Na0 + 5H2+6SO4 → 4Na2+1SO4 + H2S-2↑ + 4H2O
· концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S