Прежде чем рассмотреть кинетику мономолекулярных реакций, необходимо уточнить сам термин «мономолекулярные» применительно к тем процессам, о которых пойдет речь. Как будет видно из дальнейшего, при термическом характере активации такие реакции не могут протекать в одну стадию и, следовательно, являются реакциями сложными. Поэтому, несмотря на традиционное и широкое использование этого термина, здесь его употребление не вполне корректно, и в теории химической кинетики под мономолекулярными обычно подразумевают реакции, в которых участвует только одно исходное вещество. Одной из наиболее простых и удачных схем протекания мономолекулярных реакций стала схема Линдеманна.
В основе схемы Линдеманна лежит предположение о том, что первой стадией этих реакций является, строго говоря, не химическая реакция, а столкновительное взаимодействие — бимолекулярное соударение реагента А с любой частицей (с инертным газом, продуктом реакции и с другой молекулой А в том числе), которое при благоприятных обстоятельствах приводит к ее активации, т.е. приобретению энергии, достаточной для перехода через потенциальный барьер,
 (1)
(1)
Далее активная молекула А* может еще раз столкнуться с М и дезактивироваться, причем в отличие от (1) каждое столкновение приводит к дезактивации
 (2)
(2)
Последнее предположение физически означает равенство константы k1 средней частоте бимолекулярных столкновений Z0, которую легко найти из молекулярно-кинетической теории. Если, однако, такое дезактивирующее столкновение запаздывает, то активная молекула А* может превратиться в продукты реакции

Таким образом, центральным моментом в схеме Линдеманна является идея о бимолекулярных столкновениях как о единственно возможном пути термической активации частиц реагента в мономолекулярных (односубстратных) реакциях.
Используем метод стационарных концентраций и найдем кинетическое уравнение реакции, исходя из записанных выше стадий (1-2) и полагая, что в них М = А. Поскольку концентрация активных молекул А * весьма мала, то можно считать ее стационарной

откуда найдем

Тогда скорость реакции, определяемая по расходу реагента А или накоплению продукта Р равна
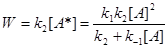 (3)
(3)
Если давление, а следовательно, и концентрация [ А ] достаточно велики, так что k-1[ A ] >> k2 то уравнение (3) перейдет в
 (4)
(4)
т.е. в кинетическое уравнение, отвечающее первому порядку по концентрации реагента А. Напротив, при малых давлениях, когда k2 >> k-1 [А],
 (5)
(5)
и реакция имеет второй кинетический порядок.
Физический смысл этих двух предельных случаев, которым соответствуют кинетические уравнения (4) и (5), вполне ясен в рамках схемы Линдеманна. При малых давлениях вероятность бимолекулярных столкновений невелика, и именно эта стадия является лимитирующей — скорость всего процесса растет пропорционально квадрату концентрации. При больших давлениях, напротив, скорости активации и дезактивации достаточно велики, и лимитирующей стадией становится собственно химическое превращение, а первые две быстрые стадии обеспечивают квазиравновесное распределение частиц по энергиям; здесь скорость реакции пропорциональна первой степени концентрации. Следует также отметить, что во втором случае отношение k1/k-1 в кинетическом уравнении (4) является просто константой равновесия процесса активации.
Таким образом, схема Линдеманна предполагала единый для всех химических реакций с термическим характером активации путь приобретения реагентами избыточной энергии через бимолекулярные столкновения, и в этом состоял ее первый важнейший результат. Во-вторых, она вполне естественным путем объясняла, почему, в мономолекулярных реакциях при варьировании давления в реакционной системе наблюдается изменение кинетического порядка. Если записать уравнение (3) в несколько ином виде

то это же обстоятельство может быть отражено в виде зависимости наблюдаемой константы скорости от концентрации
 (6)
(6)
Общий вид зависимости kэфф = f([A]) приведен на рис. 1.

Рис. 1. Зависимость наблюдаемой константы скорости мономолекулярной реакции от концентрации реагирующего вещества
Кривые такого типа получали неоднократно, когда исследовали кинетику мономолекулярных реакций в широком интервале концентраций исходных веществ или общих давлений. Эти экспериментальные результаты могли рассматриваться как хорошее качественное подтверждение правильности схемы, предложенной Линдеманном для мономолекулярных реакций.
Эффективную константу скорости, отвечающую наблюдаемой константе скорости реакции 1-го порядка, можно привести к линейному виду в обратных координатах:

Кроме того, время жизни активных молекул можно оценить, как 
В то же время детальный количественный анализ констант скорости в модели Линдеманна, определенных на основании кинетических экспериментов, почти сразу же обнаружил существенные расхождения теоретических и опытных величин. В частности, опытным путем можно было установить, при какой концентрации реагента или общем давлении имеет место переход от первого кинетического порядка ко второму; эта концентрация [А] соответствует значению kэфф = k∞/2. С другой стороны, из (6) следует, что
 (7)
(7)
Поскольку к в рамках схемы Линдеманна является константой скорости бимолекулярной реакции (1), то ее вычисляли по уравнению Траутца-Льюиса и далее, найдя теоретическое значение [ A ]1/2, сравнивали его с экспериментальной величиной. Результат сравнения был не в пользу теории: при варьировании давления первый порядок реакции наблюдали при значительно меньших давлениях, чем предсказывала теория. Иначе говоря, расчетная величина к была очень сильно занижена, в некоторых случаях на несколько порядков. В рамках теории столкновений такой результат означал, что столь же значительны различия между истинными и расчетными величинами сечения химической реакции. Такие существенные различия представлялись малоправдоподобными, если исходить из простой модели столкновений, где реагирующие молекулы рассматриваются как бесструктурные жесткие сферы и где единственным источником активации реагентов является их поступательная энергия, а доля активных столкновений определяется критическим значением кинетической энергии столкновения по линии центров. Кроме того, схема Линдеманна предусматривала временную задержку между актом активации и превращение активированной частицы в продукт, что противоречит величине частоты колебаний двухатомной частицы, а следовательно времени, необходимому для разрыва связи между образующими ее атомами.
Поправка Хиншельвуда
Главная идея Хиншельвуда заключалась в том, что помимо кинетической энергии, которая в результате неупругих столкновений переходит во внутреннюю вращательно-колебательную энергию молекул, эти молекулы сами по себе обладают определенным запасом собственной внутренней энергии; она в принципе также может быть использована для активации. Это предположение вносит существенные коррективы в простую схему Линдеманна. В отличие от последней, где протекание реакции обусловливается превышением кинетической энергией столкновения по линии центров над некоторым пороговым уровнем ε а модель Хиншельвуда рассматривает другое, более общее условие: этот порог может быть превышен молекулой А не только за счет энергии столкновения, но и путем перераспределения ее собственной энергии колебаний.
Что касается второй стадии схемы Линдеманна — столкновительной дезактивации, а также третьей стадии — химического превращения, то их константы в теории Хиншельвуда принимаются существенно постоянными.
Итак, по Хиншельвуду, после бимолекулярного столкновения частица А активируется в узкий интервал энергий ε, ε + dε
 (8)
(8)
Если в столкновительной активации принимает участие f колебательных степеней свободы молекулы, то для каждой из них энергия выражается двумя квадратичными членами, соответствующими кинетической и потенциальной энергией осциллятора. Тогда полной колебательной и поступательной энергии, участвующей в этом процессе, отвечают
s = 2 f + 2 (9)
квадратичных членов. Вероятность попадания энергии молекулы, которая выражается s квадратичными членами, в интервал ε, ε + dε определяется как
 (10)
(10)
или

Вероятность того, что ε ≥ ε а найдем из (10)
 (11)
(11)
При ε a /kT >> 1интеграл в правой части (11) приблизительно равен
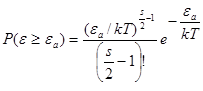
Поскольку частота всех бимолекулярных столкновений определяется соотношением
z0 = 
то частота столкновений, приводящих к активации молекул, т.е. константа скорости активации по Хиншельвуду равна

Выражение в квадратных скобках носит название поправки Хиншельвуда (в уравнении Траутца-Льюиса).
Таким образом, для многоатомных молекул, подбирая число колебательных степеней свободы, которые участвуют в перераспределении энергии при столкновительной активации, можно вполне удовлетворительно согласовать теорию активных столкновений с экспериментом. Положительным моментом модели Хиншельвуда было то обстоятельство, что число таких «активных» степеней свободы f для превращения N-атомных молекул никогда не превышало величину 3N-6(5), т.е. число нормальных колебаний.
Предварительно вернемся к теме предыдущего семинара и обсудим возможные способы расчета газокинетических диаметров сталкивающихся частиц. Значение радиуса частицы, входящего в выражение сечения соударения, можно оцеть по вязкости газа или плотности жидкости:
 где М – молекулярная масса, в г, η – динамическая вязкость, выраженная в Пуазах [г/см·с]
где М – молекулярная масса, в г, η – динамическая вязкость, выраженная в Пуазах [г/см·с]
 , где ρ – плотность жидкости в [г/см3]
, где ρ – плотность жидкости в [г/см3]
Задача.
Смесь брома с этиленом при равных парциальных давлениях в 3 мм рт.ст. имеет температуру 298 К. Рассчитать частоту соударений в единице объема для пар Br2 + Br2, C2H4 + C2H4 и Br2 + C2H4. Принять плотности жидкостей: ρ Br2 = 3,1 г/см3, ρ С2Н4 = 0,4 г/см3. Молекулярная масса Br2 160 г/моль, С2Н4 28 г/моль.
Решение



Задача



Решение.

Задача.
Вычислить максимально возможную скорость мономолекулярной реакции распада С2Н5Cl при температуре 750 К, давлении 100 мм рт.ст., если энергия молекулы описывается через 2s = 12 квадратичных членов, опытная энергия активации EA = 60800 кал/моль и эффективный диаметр соударений d = 4,5·10–8 см.
Решение
Максимально возможная скорость мономолекулярной реакции по схеме Линдеманна равна первой стадии схемы – скорости активации. Поскольку первая стадия является бимолекулярной, используем формулу Траутца-Льюиса, домноженную на концентрацию для сохранения размерности [время–1]. Напомним, что размерность константы при подстановки R в эргах: см3/молекула·с; переход от молекулы к молю – путем умножения на число Авогадро, а от см3 к литрам, - умножением на 10–3.. Итак:

С – концентрация исходного вещества моль/см3
Найдем связь между энергией активации по Аррениусу (опытной) и ЕТАС (энергией активации в ТАС). Пусть k1 = const·T1/2 – (s – 1)· exp (–ETAC/RT)
Все остальные сомножители вносим в const/
k1 = const·T–(s– 3/2)· exp (–ETAC/RT)
Логарифмируем и берем от левой и правой частей производную по температуре
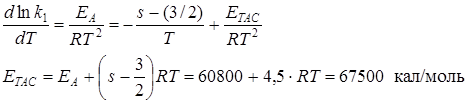
 моль/см3
моль/см3
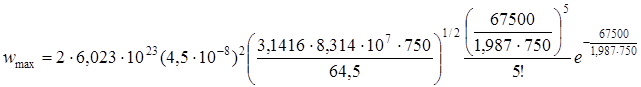 х (2,14·10–6)2 = 2,08·10–10 моль/см3·с
х (2,14·10–6)2 = 2,08·10–10 моль/см3·с
Замечание: Если отсутствует информация о стерическом множителе, его принимают равным единице.
Задача
Опытное значение константы скорости разложения N2O
N2O → N2 + ½ O2 при 1085 К и давлении 1,15 атм равно 5,7·10–4 с–1. Рассчитайте с помощью теории соударений и схемы Линдеманна энергию активации данной реакции, полагая, что эффективный диаметр столкновений равен 3,3·10–8 см, а стерический фактор равен единице.
Ответ: ЕТАС = 258,2 кДж/моль
Возможно самостоятельное решение задачи студентами.
Дом. задание 6.
1. Оценить энергию диссоциации двухатомной молекулы A-B в газе, состоящем только из молекул AB, если известно, что при 500оС время полураспада AB составляет 69,18 мин при начальном давлении 2,89 мм рт.ст. и 115,53 мин при 0,57 мм рт.ст. Воспользуйтесь теорией мономолекулярных реакций Линдеманна, приняв значение предэкспоненциального множителя A¥ при Р ® ¥ равным 1013,5 с-1.
2. Константа скорости мономолекулярной реакции разложения:
C3H7N=NC3H7 ® N2 + C6H14 выражается эмпирическим уравнением: k = 5,71×1013×e-40900/RT. Найти максимально возможное с точки зрения теории соударений значение предэкспоненциального множителя при Т = 563 К, приняв эффективный диаметр молекулы 5×10-8 см, концентрацию реагирующего соединения 4,464×10-2 моль/л.
3. Термическая изомеризация циклопропана в пропилен изучена при 500оС и различных начальных давлениях. Экспериментальные данные приведены в таблице:
Ро, мм рт.ст. 2,89 0,57 0,17 0,12 0,10
kэфф.×104, с-1 1,67 1,00 0,50 0,38 0,33
Здесь kэфф. определяли как начальную скорость, деленную на начальную концентрацию. Определить константы скорости стадий активации и распада активированных молекул, если дезактивация происходит при каждом соударении. Принять величину предэкспоненциального множителя при Р ® ¥ А¥ = 1013,5 с-1.
4. Зависимость эффективной константы скорости мономолекулярной реакции разложения диметилового эфира, протекающей при температуре 777 К, от начальной концентрации дается уравнением:  = 1,18×103 +
= 1,18×103 +  Опытное значение энергии активации ЕА = 58500 кал/моль. Принимая, что каждое столкновение между активной и нормальной молекулой в соответствии со схемой Линдеманна приводит к дезактивации, определите среднее время жизни активных молекул, если энергия активации молекулы описывается через 2s = 12 квадратичных членов.
Опытное значение энергии активации ЕА = 58500 кал/моль. Принимая, что каждое столкновение между активной и нормальной молекулой в соответствии со схемой Линдеманна приводит к дезактивации, определите среднее время жизни активных молекул, если энергия активации молекулы описывается через 2s = 12 квадратичных членов.