Силы электростатического взаимодействия между молекулами, возникающие без передачи атомами электронов на расстояниях, превышающих длину связи, называются вандерваальсовыми силами. Различают три вида такого взаимодействия: ориентационное, индукционное и дисперсионное. Ориентационное взаимодействие проявляется между полярными молекулами, индукционное – при действии полярной молекулы на неполярную, а дисперсионное – является универсальным, так как проявляется в любых случаях.
Индукционное взаимодействие между молекулами является второстепенным, по сравнению с ориентационным и дисперсионным. С увеличением полярности молекул возрастает роль ориентационных сил, а повышение поляризуемости (деформируемости) частицы усиливает роль дисперсионного взаимодействия.
Наличие вандерваальсовых сил обусловливает притяжение молекул и агрегацию вещества с образованием молекулярных кристаллов. Такие силы гораздо слабее, чем ковалентная или ионная связь, поэтому вещества с молекулярно-кристаллическим строением характеризуются невысокими температурами плавления, способностью к возгонке и малой твердостью.
Промежуточное положение между химической связью и вандерваальсовыми взаимодействиями занимает водородная связь (ВС), которая возникает между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом F, O или N (реже – Cl или S), принадлежащим другой молекуле. ВС проявляется тем сильнее, чем больше ЭО и меньше радиус атома-партнера.
Возникновение ВС обусловлено способностью атома водорода глубоко внедряться в электронную оболочку атома с высокой ЭО из-за своего малого размера и отсутствия внутренних электронных слоев. Энергия ВС невелика (8 – 80 кДж/моль), поэтому такую связь легко разрушить.
Наличие ВС является причиной объединения молекул в димеры или более сложные ассоциаты, а также объясняет аномально высокие температуры кипения и плавления некоторых веществ, так как на разрыв таких связей требуется дополнительная затрата энергии.
§5. Водородная связь.
Возможность образования водородной связи являетсярезультатом особых свойств атома водорода, а именно – наличия у него одного единственного электрона. Если этот электрон полностью или частично переходит к другому атому, то остаётся в той или иной мере неэкранированный протон (частица с единичным положительным зарядом и очень малым радиусом). Это создает возможность для взаимодействия между таким атомом водорода и неподеленной электронной парой принадлежащего другой молекуле сильно электроотрицательного атома (такого как, фтор, кислород или азот). При этом атом водорода, несущий значительный положительный заряд, внедряется в электронное облако другого атома (отрицательный заряд).
Таким образом, водородная связь – это специфический вид взаимодействия между молекулами, носящий донорно-акцепторный характер. От обычного межмолекулярного взаимодействия водородная связь отличается также своей избирательностью (образуется лишь с определенными атомами), направленностью и насыщаемостью.
Химическая связь, образованная положительно поляризованным водородом молекулы А – Н (или полярной группы – А – Н) и электроотрицательным атомом В другой или той же молекулы, называется водородной связью.
Наличие неподелённой электронной пары у атома, входящего в состав другой молекулы, - необходимое условие образования водородной связи. Прочность водородной связи определяется полярностью связи водорода с другим атомом. Так, в ряду HF - H2O - NH3 полярность связи Н – Х уменьшается, поэтому водородная связь наиболее прочна в случае HF и менее – в случае NH3. Для полярной молекулы HCl связь является гораздо более слабой из-за большего по сравнению со фтором размера атома хлора.
Энергия (и прочность) водородной связи выше энергии обычного межмолекулярного взаимодействия, хотя и ниже энергии обычных ковалентных связей. Так, энергия водородной связи между молекулами NH3, Н2О и HF имеет следующие значения (кДж/моль):
| Ковалентная связь | Водородная связь | |
| NH3 | ||
| Н2О | ||
| HF |
Вследствие существования межмолекулярных водородных связей температуры кипения NH3, Н2О и HF оказываются значительно выше температур кипения РН3, Н2S и HCl.
Энергия водородной связи возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов В. Поэтому наиболее прочные водородные связи возникают, когда в качестве атомов В выступают F, O или N.
При возникновении водородных связей образуются димеры, тримеры или полимерные структуры, например зигзагообразные структуры (HF)n, кольцевые структуры некоторых органических кислот, например уксусной кислоты
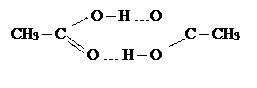 |
 или более сложные конфигурации, например у льда, у которого молекулы воды образуют по четыре водородные связи
или более сложные конфигурации, например у льда, у которого молекулы воды образуют по четыре водородные связи
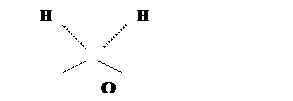 |
соответственно в жидком состоянии молекулы вступающие в водородные связи, ассоциированы, а в твёрдом состоянии образуют сложные кристаллические структуры.
Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температуры кипения и плавления, теплот плавления и парообразования.
Водородная связь может возникнуть между атомами водорода и отрицательными атомами полярных групп в одной и той же молекуле (внутримолекулярная связь). Примером может служить ортооксибензойная (салициловая) кислота (рис.). Здесь водородная связь осуществляется между водородом гтдроксогруппы и карбонильным кислородом карбоксильной группы. В этом соединении наличие водородной связи способствует отщеплению иона водорода в карбоксильной группе, вследствие чего салициловая кислота оказывается значительно более сильной, чем соответствующие мета- и пара- изомеры, в которых гидроксильная и карбоксильная группы находятся на большем расстоянии, что препятствует образованию внутримолекулярной водородной связи.
|
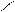

 | |||
 | |||
Рис.11. Внутримолекулярная водородная связь в молекуле салициловой кислоты.
Молекулы с внутримолекулярными водородными связями не могут вступать в межмолекулярные водородные связи. Поэтому вещества с такими связями не образуют ассоциатов, более летучи, имеют более низкие вязкости, температуры кипения и плавления, чем их изомеры, способны образовывать межмолекулярную связь.
Образование водородных связей приводит к усложнению структуры вещества, как, например, в полимерах. Изучение этих связей позволяет расшифровать не только строение веществ, но и глубже понимать механизм многих физико-химических и химических процессов, особенно протекающих в водных средах – диссоциацию кислот и оснований, гидролиз веществ, набухание полимеров и пр.