Белово 2012
ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ПУАССОНА
МЕТОДОМ КЛЕМАНА – ДЕЗОРМА
Цель работы
1.1. Экспериментально проверить основные термодинамические законы для идеального газа.
1.2. Определить коэффициент Пуассона для воздуха и сравнить его с расчетным значением.
Подготовка к работе
Прочитать в учебниках следующие параграфы: [1] – §§ 9.5–9.6, [2] – §§ 50, 53–55, [4] – §§ 21, 22. Для выполнения работы студент должен знать: а) основные уравнения термодинамических процессов; б) первое начало термодинамики; в) понятие коэффициента Пуассона; г) методы расчёта теплоты, работы и изменения внутренней энергии; д) уметь пользоваться измерительными приборами.
Выполнение работы
Описание лабораторной установки

|
Внешний вид рабочей панели и принципиальная схема экспериментальной установки ФПТ1-6н представлена на рисунке (рис.1): 1 – включатель «СЕТЬ» для питания установки; 2 – включатель «Компрессор» для нагнетания воздуха в рабочий сосуд (емкость объемом V = 3500 см3), расположенный в полости корпуса; 3 – кран К1, необходимый для предотвращения сброса давления из рабочего сосуда после остановки компрессора; 4 – пневмотумблер «Атмосфера», позволяющий на короткое время соединять рабочий сосуд с атмосферой; 5 – измеритель давления с помощью датчика давления в рабочем сосуде; 6 – двухканальный измеритель температуры, позволяющий измерить температуру внутри окружающей среды и температуру внутри рабочего сосуда.
Методика измерений и расчёта

Для идеальных газов отношение зависит только от числа степеней свободы молекул газа, которое, в свою очередь, определяется структурой молекулы, т.е. количеством атомов, из которых состоит молекула. Одноатомная молекула имеет 3 степени свободы (инертные газы). Если молекула состоит из двух атомов, то число степеней свободы складывается из числа степеней свободы поступательного движения (i =3) центра масс и вращательного (i =2) движения системы вокруг двух осей, перпендикулярных к оси молекулы, т.е. равно 5. Для трех- и многоатомных молекул i = 6 (три поступательные и три вращательные степени свободы).
В данной работе коэффициент γ для воздуха определяется опытным путем.
Если при помощи насоса в сосуд накачать некоторое количество воздуха, то давление и температура воздуха внутри сосуда повысятся. Вследствие теплообмена воздуха с окружающей средой через некоторое время температура воздуха, находящегося в сосуде, сравняется с температурой T0 внешней среды.
Давление, установившееся в сосуде, равно р1 = р0 + р', где р0 – атмосферное давление, р' – добавочное давление. Таким образом, воздух внутри сосуда характеризуется параметрами (р0 + р'), V0, T0, а уравнение состояния имеет вид
|

Если на короткое время (~3с) открыть тумблер «АТМОСФЕРА», то воздух в сосуде будет расширяться. Этот процесс расширения можно рассматривать как подключение к сосуду дополнительного объема V'. Давление в сосуде станет равным атмосферному Р0, температура понизится до Т1, а объем будет равен V0 + V'. Следовательно, в конце процесса уравнение состояния будет иметь вид
|

Разделив выражение (2) на выражение (1), получим
|

Расширение происходит без теплообмена с внешней средой, т.е. процесс является адиабатическим, поэтому для начального и конечного состояний системы справедливо соотношение
|

Охладившийся при расширении воздух через некоторое время, вследствие теплообмена с внешней средой, нагреется до комнатной температуры Т0 (изохорический процесс). Давление возрастет до некоторой
величины р2 = р0 + р'', где р'' – новое добавочное давление. Для воздуха массой m', оставшегося в сосуде, уравнение состояния в начале нагрева
|
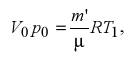
а в конце нагрева до комнатной температуры Т0
|

Разделив (5) на (6) получим
|
|

Правые части выражений (7) и (3) одинаковы, следовательно, левые части также равны
|

Возведя левые и правые части в степень γ, запишем
|

Заменим правую часть с учетом (4), получим

Поскольку  , то, ограничиваясь первым членом разложения в ряд бинома
, то, ограничиваясь первым членом разложения в ряд бинома  и пренебрегая членами второго порядка малости, получим для показателя адиабаты γ:
и пренебрегая членами второго порядка малости, получим для показателя адиабаты γ:
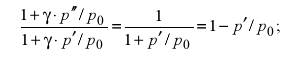

|
