Амфотерные оксиды, их характеристика.
По данной теме Вам необходимо выполнить следующие задания:
1.Изучить теоретический материал лекции по данной теме:
Основные оксиды реагируют с кислотными оксидами, а кислотные оксиды – с основаниями. Но существуют вещества, оксиды и гидроксиды которых в зависимости от условий, будут реагировать и с кислотами и с основаниями. Такие свойства называются амфотерными.
Вещества, обладающие амфотерными свойствами приведены Рис.1.. Это соединения, образованные бериллием, цинком, хромом, мышьяком, алюминием, германием, свинцом, марганцем, железом, оловом.
Примеры их амфотерных оксидов приведены в таблице 1.
| Амфотерные оксиды | |
| Формула | Названия |
| BeO | Оксид берилия (II) |
| ZnO | Оксид цинка |
| Al2O3 | Оксид алюминия |
| Cr2O3 | Оксид хрома III) |
| As2O3 | Оксид мышьяка (III) |
| GeO | Оксид германия (II) |
| PbO2 | Оксид свинца (IV) |
| MnO2 | Оксид марганца (IV) |
| Fe2O3 | Оксид железа (III) |
| SnO | Оксид олова (II) |
Химические свойства амфотерных оксидов цинка и алюминия
Рассмотрим амфотерные свойства оксидов цинка и алюминия. На примере их взаимодействия с основными и кислотными оксидами, с кислотой и щелочью.
- Взаимодействие с основными оксидами и основаниями:
ZnO + Na2O → Na2ZnO2 (цинкат натрия). Оксид цинка ведет себя как кислотный.
ZnO + 2NaOH → Na2ZnO2+ H2O
- Взаимодействие с кислотными оксидами и кислотами. Проявляет свойства основного оксида.
3ZnO + P2O5 → Zn3(PO4)2 (фосфат цинка)
ZnO + 2HCl → ZnCl2 + H2O
Аналогично оксиду цинка ведет себя и оксид алюминия:
- Взаимодействие с основными оксидами и основаниями:
Al2O3 + Na2O → 2NaAlO2 (метаалюминат натрия). Оксид алюминия ведет себя как кислотный.
Al2O3 + 2NaOH → 2NaAlO2+ H2O
- Взаимодействие с кислотными оксидами и кислотами. Проявляет свойства основного оксида.
Al2O3 + P2O5 → 2AlPO4(фосфат алюминия)
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Рассмотренные реакции происходят при нагревании, при сплавлении. Если взять растворы веществ, то реакции пойдут несколько иначе.
Химические свойства амфотерных оксидов цинка и алюминия в растворах
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия) Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
В результате этих реакций получаются соли, которые относятся к комплексным.

Рис. 2. Минералы на основе оксида алюминия
Оксид алюминия.
Оксид алюминия чрезвычайно распространенное на Земле вещество. Он составляет основу глины, бокситов, корунда и других минералов. Рис.2.
В результате взаимодействия этих веществ с серной кислотой, получается сульфат цинка или сульфат алюминия.
ZnO + H2SO4 → ZnSO4 + H2O
Al2O3 + 3H2SO4→ Al2 (SO4)3 + 3H2O
Химические свойства амфотерных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
Например, оксид алюминия взаимодействует с соляной кислотой, оксидом серы (VI), но не взаимодействует с углекислым газом и кремниевой кислотой:
амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
амфотерный оксид + кислотный оксид = соль
Al2O3 + 3SO3 = Al2(SO4)3
Al2O3 + CO2 ≠
Al2O3 + H2SiO3 ≠
Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
амфотерный оксид + вода ≠
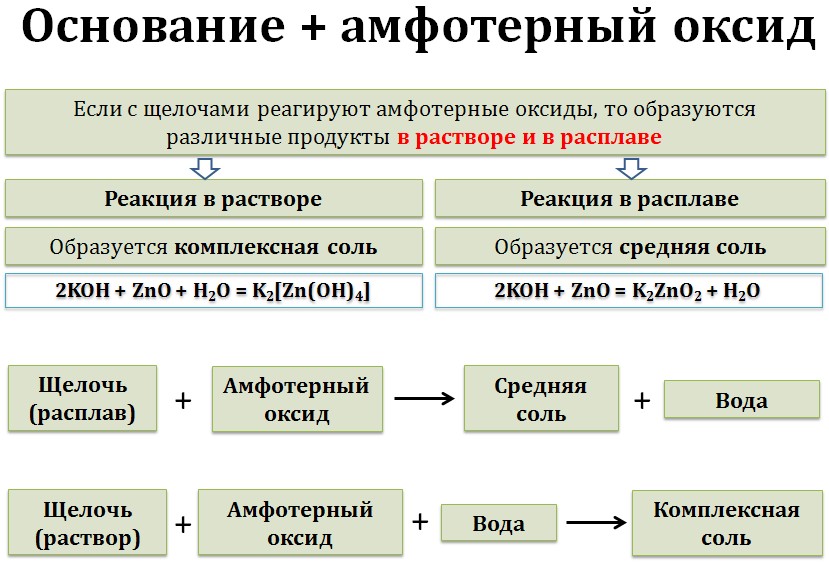
Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
1. Сначала записываем центральный атом-комплекообразователь (это, как правило, амфотерный металл).
2. Затем дописываем к центральному атому лиганды — гидроксогруппы. Число лигандов в 2 раза больше степени окисления центрального атома (исключение — комплекс алюминия, у него, как правило, 4 лиганда-гидроксогруппы).
3. Заключаем центральный атом и его лиганды в квадратные скобки, рассчитываем суммарный заряд комплексного иона.
4. Дописываем необходимое количество внешних ионов. В случае гидроксокомплексов это — ионы осн о вного металла.
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.
| Металлы | В расплаве щелочи | В растворе щелочи |
| Степень окисле-ния +2 (Zn, Sn, Be) | Соль состава X2YO2*. Например: Na2ZnO2 | Комплексная соль состава Х2[Y(OH)4]*. Например: Na2[Zn(OH)4] |
| Степень окисле-ния +3 (Al, Cr, Fe) | Соль состава XYO2 (мета-форма) или X3YO3 (орто-форма). Например: NaAlO2 или Na3AlO3 | Na3[Al(OH)6] или Na[Al(OH)4 Комплексная соль состава Х3[Y(OH)6]* или реже Х[Y(OH)4]. Например: Na[Al(OH)4] |
* здесь Х — щелочной металл, Y — амфотерный металл.
Исключение — железо не образует гидроксокомплексы в растворе щелочи!
Например:
амфотерный оксид + щелочь (расплав) = соль + вода
Al2O3 + 2NaOH = 2NaAlO2 + H2O
амфотерный оксид + щелочь (раствор) = комплексная соль
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]