Из чего состоит мембрана? Нарисуйте структурную формулу.
Биологические мембраны построены из липидов и белков, связанных друг с другом с помощью нековалентных взаимодействий. Основу мембраны составляет двойной липидный слой, в состав которого включены белковые молекулы. Липидный бислой образован двумя рядами амфифильных молекул, гидрофобные «хвосты» которых спрятаны внутрь, а гидрофильные группы - полярные «головки» обращены наружу и контактируют с водной средой.
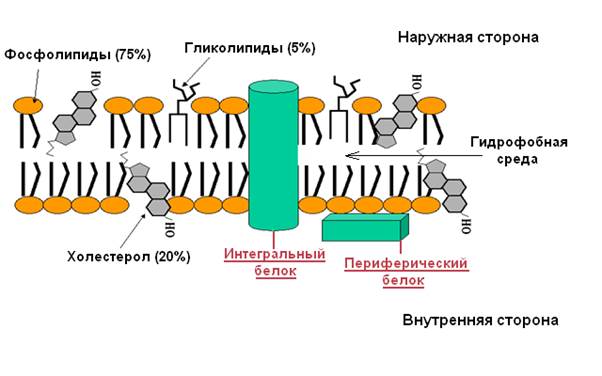
Какова функция белков в клетке? В общих чертах, как работают ферменты?
Функции:
1. Структурная. Белки образуют основу протоплазмы любой живой клетки, в комплексе с липидами они являются основой всех клеточных мембран, элементов цитоскелета (микротрубочек, микрофиламентов); входят в состав клеточных стенок (структурный белок экстенсин).
2. Ферментативная (каталитическая). Все ферменты являются белками, простыми или сложными;
3. Транспортная. Белки участвуют в переносе веществ через мембраны (белки-переносчики челночного типа и энергозависимые, ионные каналы; аквапорины «водяные поры»).
4. Запасная (запасные отложения белков семян).
5. Защитная. Иммунные белки: а) белки-ингибиторы, подавляющие ферменты патогенов, б) ферменты, вызывающие разрушение клеточных стенок мицелия грибов-паразитов (глюконазы, хитиназы); в) белки-лектины, специфически связывают (склеивают) патогенные бактерии и грибы, предотвращают дальнейшее распространение бактерий (или гиф гриба); Стрессорные белки – синтезируются под влиянием экстремальных факторов (низкие или сверхоптимальные температуры, водный дефицит, засоление и др.) (БТШ, криопротекторы).
6. Рецепторная. Входят в состав рецепторов, избирательно воспринимающих сигналы внешней и внутренней среды.
|
|
Различают белки простые, состоящие только из аминокислот (протеины) и сложные, которые включают небелковую часть.
● Простые белки (протеины) разделяют по растворимости их в определенных растворителях:
Альбумины - растворяются в воде.
Глобулины – белки, растворимые в слабых растворах нейтральных солей.
Проламины - хорошо растворимы в 60-80%-ном этаноле, характерны исключительно для семян злаков, они бедны незаменимыми аминокислотами, но содержат много пролина и глутаминовой кислоты.
Глютелины - хорошо растворимы в щелочных растворах (0,2-2,0%). Запасные белки растений, содержатся в семенах злаков; совместно с проламинами составляют клейковину – комплекс запасных белков злаковых культур. Клейковина сообщает муке способность превращаться в тягучее тесто и качествами ее определяется достоинство муки.
Гистоны - белки щелочного характера, играют важную роль в формировании структуры хроматина (до 40-50% от массы хромосом, содержат много основных аминокислот - арг, лиз).
● Сложные белки (устаревшее название протеиды) классифицируют по химизму небелковой (простетической) части молекулы.
Липопротеины – простетической (небелковой) группой являются различные жироподобные вещества; входят в состав клеточных мембран.
Металлопротеины – комплексы ионов металлов с белками; в составе металлопротеинов часто встречаются: Cu, Fe, Zn, Mo, Mn, Ni, Se, Ca и др.
Гликопротеины - содержат углеводный компонент. Входят в БМ (рецепторная функция, защитная – лектины реакция агглютинации).
|
|
Нуклеопротеины - соединение белков с нуклеиновыми кислотами (рибосомы, хромосомы).
Хромопротеины - сложные белки, у которых небелковой частью оказываются окрашенные соединения, например, Fe-порфириновые структуры (гемоглобин крови, легоглобин); «желтые дыхательные ферменты», в состав которых входят коферменты флавинадениндинуклеотид - ФАД, флавинаденинмононуклеотид – ФМН.
Ферменты (закваска) - специфические катализаторы белковой природы, ускоряющие течение биохимических реакций и играющие важнейшую роль в обмене веществ.
Свойства ферментов
· Они не расходуются в процессе катализа и не входят в состав конечных продуктов реакции, выходят из реакции в первоначальном виде.
· По химической природе все ферменты – белки.
· Эффективность ферментов значительно выше по сравнению с катализаторами небиологической природы. Например, 1 моль Fe за 1 мин разлагает 10-5 моль Н2О2, а каталаза, содержащая атом Fe - 105 моль Н2О2).
· Регулируемость. Активность ферментов, скорость ферментативных реакций регулируется в зависимости от потребностей самой клетки.
· Специфичность. Они обладают избирательностью действия на субстраты, т.е., на те вещества, превращение которых они катализируют. Специфичность ферментов может быть абсолютной (фермент уреаза – разложение мочевины) или относительной (протеазы – распад белков, имеющих разное происхождение). Специфичность ферментов лежит в основе международной классификации ферментов.
Кофакторы (активаторы) - вещества небелковой природы (часто металлы - К, Са, Mg, Mn, Zn, Mo; Cl), усиливают каталитическую активность ферментов, стабилизируя структуру белковой части фермента. Ингибиторы - вещества, подавляющие активность ферментов; они частично или полностью препятствуют образованию фермент-субстратного комплекса (яды, лекарственные препараты, ионы тяжелых металлов и др.).
Область молекулы фермента, в которой происходит связывание, и превращение субстрата называется активным центром. Активный центр расположен в углублении на поверхности молекулы фермента (рис.).
В ходе ферментативной реакции осуществляется контакт между ферментом (E) и субстратом (S) с образованием промежуточного фермент-субстратного комплекса (ES).