Урок №__
Тема: «Алкины или ацетиленовые УВ ».
Изучить материал урока, оформить конспект. Для закрепления написать уравнения реакции и решить задачу.
Алкины (ацетиленовые углеводороды) – углеводороды, молекулы которых содержат тройную связь углерод-углерод. Общая формула алкинов – CnH2n-2.
Номенклатура алкинов
Тройную связь обозначают суффиксом - ин.
| ацетилен (этин) | бутин-1,бутин-2 |
| H–C ≡ C – Н | CH≡ C – CH2 – CH3 CH3 – C≡ C – CH3 |
Главная цепь должна включать в себя тройные связи, а нумерация проводится так, чтобы они получили наименьшие номера.
1 2 3 4 5 1 2 3 4 5
CH ≡ C – CH – CH2 – CH3 CH ≡ C – CH2 – CH – CH3
| |
СН3 CН3
3-метилпентин-1 4метилпетин- 1

Рис. 1. Шаростержневая модель ацетилена
Строение алкинов
Атомы углерода тройной связи находятся в состоянии sp -гибридизации. Сигма-связи, образуемыеsp-гибридными атомами углерода, расположены под углом 180о друг к другу.
Тройная связь короче и прочнее двойной связи. Она образована тремя парами электронов и включает одну σ- и две π-связи. Две π-связи лежат во взаимно перпендикулярных плоскостях.
. Физические свойства.
C2H2 – C4H6 – газы, C5H8 – C15H28 - жидкости, C16H30 – … – твердые вещества. Алкины плохо растворимы в воде, но лучше, чем алканы и алкены. Их температуры плавления и кипения, также как у алканов и алкенов, закономерно повышаются при увеличении молекулярной массы соединения. Алкины имеют специфический запах.
Структурная изомерия:
А) изомерия углеродного скелета
1 2 3 4 5 1 2 3 4
CH≡C – CH2 – CH2 – CH3 CH≡C – CH – CH3
|
CH3
пентин-1 3-метилбутин-1
Б) изомерия положения кратной связи
1 2 3 4 5 1 2 3 4 5
CH≡C – CH2 – CH2 – CH3 CH3–C ≡ C – CH2 – CH3
пентин-1 пентин-2
в) изомерия положения заместителей (Hal, - NO2, SO2-OH и др.)
1 2 3 4 5 1 2 3 4 5
CH ≡ C – CH – CH2 – CH3 CH ≡ C – CH2 – CH – CH3
| |
Cl Cl
3-хлорпентин-1 4-хлорпентин-1
Пространственная геометрическая изомерия для алкинов, в отличие от алкенов, не характерна.
Межклассовая изомерия (с алкадиенами и циклоалкенами)
1 2 3 4 5 1 2 3 4 5
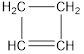
CH ≡ CH – CH2 – CH2 – CH3 CH2=CH – CH = CH – CH3 CH = CH
пентин-1 1,3-пентадиен | |
CH2 CH2
\ /
CH2
циклопентен
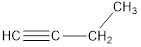
| 
| 
|
| бутин-1 | бутадиен-1,3 | циклобутен |
Получение алкинов
1. В промышленности ацетилен получают термическим разложением (пиролизом) метана: 2СН4 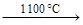 С2Н2 + 3Н2.
С2Н2 + 3Н2.
2. Для получения ацетилена в лаборатории и в технических целях используют взаимодействие карбида кальция с водой:
СаC2 + Н2О → Сa(OH)2 + C2H2.
3. Другие алкины в лаборатории получают взаимодействием дигалогеналканов, содержащих атомы галогенов у одного или у соседних атомов углерода, со спиртовым раствором щелочи при нагревании:
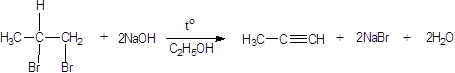
Реакции присоединения (двойное присоединение – в два ступени).
Гидрирование (в присутствии металлических катализаторов – Pt, Pd, Ni):
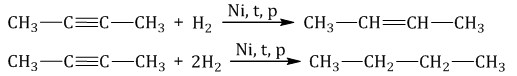
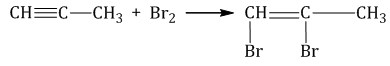
Галогенирование
Br
1 2 3 1 2| 3
CH2=C – CH3 + H – Br ----- CH3 – C – CH3 II ступень
| |
Br Br
2-бромпропен 2,2- дибромпропан
Реакция алкинов с бромной водой – качественная реакция на алкины (бромная вода обесцвечивается).
гидрогалогенирование (по правилу Марковникова: при присоединении веществ с полярной ковалентной связью типа HX (где X – это -Hal, -OH и т.д.) к несимметричным непредельным углеводородам по месту разрыва П-связи атом водорода присоединяется к наиболее гидрированному атому углерода, а X – к наименее гидрированному атому углерода)
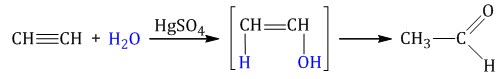
гидратация (по правилу Марковникова): ацетилен образует альдегид, его гомологи – кетоны (реакция Кучерова М. Г.)
Горение
t°
2 C2H2 + 5 O2 (избыток) –––––– 4 CO2 + 2 H2O
t°
2 C2H2 + 3 O2 (недостаток) –––––– 4 CO + 2 H2O
t°
2 C2H2 + O2 (сильный недостаток) –––––– 4 C + 2 H2O
Смеси ацетилена с воздухом или кислородом взрывоопасны; ацетилен может также взрываться при ударах.
Полимеризация
t0, kt, P
…+ CH2≡CH2 + CH2≡CH2 + …–––––– …-CH2 = CH2 – CH2 = CH2-…
ацетилен полиацетилен
t0, kt, P
nCH ≡ CH –––––– (– CH = CH –)n
мономер структурное звено
где n – это степень полимеризации
t0, kt, P
n CH3 – C ≡ CH ––––––– (– C = CH –)n
|
CH3
пропин полипропин
(метилацетилен) (полиметилацетилен)
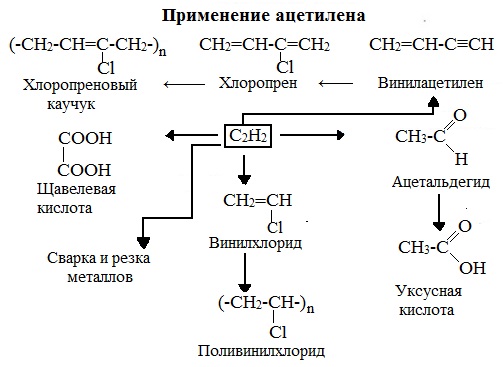
Задания на закрепление
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а)метан---ацетилен ---альдегид
б) карбид кальция---ацетилен----углекислый газ
в) этан —>этен —» этин —> бензол.
Термохимическое уравнение реакции горения ацетилена имеет вид
2С2Н2 + 502 -> 4С02 + 2Н2О + 2 600 кДж.
Рассчитайте количество теплоты, которое выделится при сгорании 56 м3 ацетилена (н.у.).