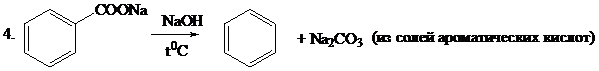Задание
Конспект
1. Алкины
2. Арены
Алкины
Цель урока: изучить строение, номенклатуру, способы получения, физические и химические свойства, применение алкинов
План лекции:
1. Строение алкинов
2. Способы получения
3. Физические свойства
4. Химические свойства
5. Применение алкинов
Алкины (ацетиленовые углеводороды) – ненасыщенные углеводороды, имеющие в своём составе тройную С≡С связь. Общая формула алкинов с одной тройной связью СnH2n-2
Простейший представитель ряда алкинов СНºСН имеет тривиальное название ацетилен.По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путём замены суффикса –ан на –ин: этан (СН3-СН3) – эт ин (СНºСН); пропан (СН3-СН2-СН3) - проп ин (НСºС-СН3); и т.д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь (т.е. она может быть не самой длинной). Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. Цифра, обозначающая положение тройной связи, ставится обычно после суффикса – ин. Часто алкины называют по принципу замещения атомов водорода в ацетилене на углеводородные радикалы, например, метилацетилен НСºС-СН3.
В образовании тройной связи участвуют атомы углерода в sp -гибридизованном состоянии. Каждый из них имеет по две sp -гибридных орбитали, направленных друг к другу под углом 1800, и две негибридных р-орбитали, расположенных под углом 900 по отношению друг к другу и к sp -гибридным орбиталям.
Пространственное строение ацетилена:

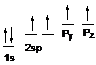
Виды изомерии: 1) изомерия положения тройной связи; 2) изомерия углеродного скелета; 3) межклассовая изомерия с алкадиенами и циклоалкенами. Пространственная изомерия относительно тройной связи в алкинах не существует.
Способы получения
1. СаО + 3С  СаС2 + СО; СаС2 + 2H2O®Ca(OH)2 + СHºCH (получение ацетилена)
СаС2 + СО; СаС2 + 2H2O®Ca(OH)2 + СHºCH (получение ацетилена)
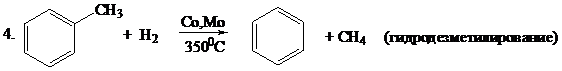
2. 2CH4 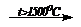 НCºСН + 3H2 (крекинг углеводородов)
НCºСН + 3H2 (крекинг углеводородов)
3. CH3-CHCl2 + 2KOH 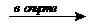 HCºСH + 2KCl + H2O (дегалогенирование)
HCºСH + 2KCl + H2O (дегалогенирование)
CH2Cl-CH2Cl + 2KOH 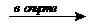 HCºСH + 2KCl + H2O
HCºСH + 2KCl + H2O
Физические свойства
Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных условиях алкины С2Н2-С4Н6 – газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов. Алкины плохо растворимы в воде, лучше – в органических растворителях.
Химические свойства
Для алкинов характерны реакции присоединения, замещения терминального атома водорода. Алкиныполимеризуются, изомеризуются, вступают в реакции конденсации. Алкины труднее, чем алкены вступают в реакции присоединения.
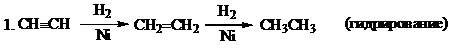
2. HСºCH + Br2®CHBr=CHBr; CHBr=CHBr + Br2® CHBr2-CHBr2 (присоединениегалогенов, качественнаяреакция)
3. HСºСН + HCl®ClCH=CH2; ClCH=CH2 + HCl®Cl2C-CH3 (присоединение галогеноводородов по правилу Марковникова)
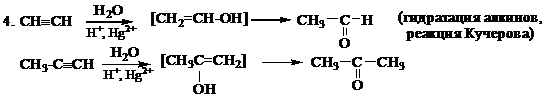
5. СHºCH + 2Ag2O  AgCºCAg¯ + H2O (образование ацетиленидов, качественная реакция на концевую тройную связь)
AgCºCAg¯ + H2O (образование ацетиленидов, качественная реакция на концевую тройную связь)
6. 3HСºCH  C6H6 (бензол) (циклоолигомеризация, реакция Зелинского)
C6H6 (бензол) (циклоолигомеризация, реакция Зелинского)
Применение алкинов
Наибольшее практическое значение имеют ацетилен и винилацетилен. Ацетилен используется для получения самых разнообразных веществ: уксусной кислоты, поливинилхлорида, синтетического каучука. Винилацетилен является важным промежуточным продуктом в производстве масло- и бензостойкого синтетического хлоропренового каучука.
Арены (ароматические углеводороды)
Цель: изучить строение, способы получения, химические свойства, применение аренов, правило ориентации заместителей в ароматическое ядро.
План лекции:
1. Строение аренов
2. Способы получения
3. Химические свойства бензола
4. Классификация заместителей
5. Химические свойства гомологов бензола
6. Применение аренов
Арены или ароматические углеводороды – это циклические соединения, молекулы которых содержат устойчивые циклические группы атомов с замкнутой системой сопряженных связей, объединяемые понятием ароматичности, которая обуславливает общие признаки в строении и химических свойствах. Термин "ароматические соединения" возник давно в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах. Однако в настоящее время в понятие "ароматичность" вкладывается совершенно иной смысл. Ароматичность молекулы означает её повышенную устойчивость, обусловленную делокализациейp-электронов в циклической системе. Критерии ароматичности аренов: 1) атомы углерода в sp2 -гибридизованном состоянии образуют циклическую систему; 2) атомы углерода располагаются в одной плоскости (цикл имеет плоское строение); 3) замкнутая система сопряжённых связей содержит (4n+2) p-электронов, где n – целое число (правило Хюккеля).
Простейший представитель: бензол С6Н6 - родоначальник ароматических углеводородов. Каждый из шести атомов углерода в молекуле бензола находится в состоянии sp2 -гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя s-связями. Валентные углы между каждой парой s-связей равны 1200. Таким образом, скелет s-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все s-связи С-С и С-Н лежат в одной плоскости. р-электроны всех атомов углерода взаимодействуют между собой путём бокового перекрывания соседних 2р-атомных орбиталей, расположенных перпендикулярно плоскости s-скелета бензольного кольца. Они образуют единое циклическое p-электронное облако, сосредоточенное над и под плоскостью кольца. Все связи С-С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф.Кекуле), а все они выровнены (делокализованы). Поэтому структурную формулу бензола ещё изображают в виде правильного шестиугольника (s-скелет) и кружка внутри него, обозначающего делокализованныеp-связи.
Видмолекулыбензола:
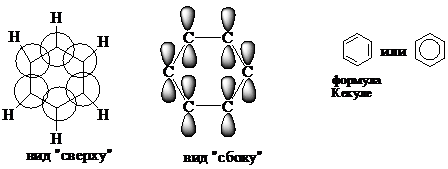
Виды изомерии (структурная): 1) положения заместителей для ди-, три- и тетра-замещенных бензолов (например, о-, м- и п-ксилолы); 2) углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода; 3) изомерия заместителей (R), начиная с R=С2Н5. Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует.
Способы получения
1. C6H12 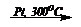 C6H6 + 3H2 (дегидрирование циклоалканов)
C6H6 + 3H2 (дегидрирование циклоалканов)
2. н -C6H14 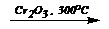 C6H6 + 4H2 (дегидроциклизацияалканов)
C6H6 + 4H2 (дегидроциклизацияалканов)
3. 3C2H2 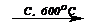 C6H6 (циклотримеризация ацетилена, реакция Зелинского)
C6H6 (циклотримеризация ацетилена, реакция Зелинского)