Храпко Наталья Вячеславовна
Автореферат диссертации на соискание ученой степени кандидата химических наук
Краснодар 2006
Работа выполнена на кафедре аналитической химии Кубанского государственного университета
Актуальность темы. Воздействие на человека неблагоприятных факторов окружающей среды, таких как УФ-излучение, радиация, загрязнения атмосферы и пищевых продуктов химическими соединениями приводит к образованию в организме избыточного количества свободных радикалов, тем самым вызывая дисбаланс в его антиоксидантном статусе.
Источниками антиоксидантов для человека могут служить пищевые продукты и напитки на основе растительного сырья, антиоксидантные свойства которых обусловлены такими биологически активными веществами как фенольные соединения, витамины, протеины, сахара, карбоновые и аминокислоты. Поэтому антиоксидантная активность (АОА) пищевых продуктов является одним из показателей, определяющих их биологическую ценность. Антиоксиданты также широко используются для предотвращения окислительной порчи жиров и жиросодержащих продуктов в процессе производства и хранения. Однако применение синтетических антиоксидантов ограничено из-за их возможного токсического действия. Это проводит к необходимости поиска альтернативных соединений в растительном сырье, обладающих высокой антиоксидантной активностью и безвредных для человека.
В настоящее время наиболее популярны методы оценки антиоксидантной активности, основанные на ингибировании окисления различных липидных субстратов с последующим определением продуктов окисления. Большинство этих методов, относящихся к данной группе, являются длительными и дают плохо воспроизводимые результаты, поэтому разработка новых методов определения, сочетающих экспрессность с достоверностью и высокой воспроизводимостью полученных данных, остаются актуальной задачей.
Настоящая работа выполнялась при финансовой поддержке РФФИ (гранты № 03-03-96548, № 06-03-96616).
Цель работы. Исследование индикаторной системы Fe(III)/Fe(II)−о-фенантролин и разработка на её основе способа определения интегральной антиоксидантной активности растительного сырья и пищевых продуктов.
В соответствие с целью исследования в работе поставлены следующие задачи:
теоретически обосновать и экспериментально доказать возможность использования индикаторной системы Fe(III)/Fe(II)–о-фенантролин для разработки спектрофотометрического способа оценки антиоксидантной активности растительного сырья и пищевых продуктов;
исследовать влияние индивидуальных восстановителей органической природы и их смесей на индикаторную систему;
оценить суммарную антиоксидантную активность и провести сопоставительный анализ ее величины с известными суммарными характеристиками ряда пищевых продуктов и растительного сырья.
Научная новизна. Предложена и изучена индикаторная система Fe(III)/Fe(II)−о-фенантролин для оценки антиоксидантной активности пищевых продуктов и растительных материалов. Исследовано влияние восстановителей фенольной и нефенольной природы, присутствующих в пищевых продуктах, на индикаторную систему и показан суммарный характер измеряемой величины антиоксидантной активности.
Показана возможность использования величины суммарной антиоксидантной активности для характеристики качества пищевых продуктов и растительного сырья.
Практическая значимость. Предложен способ определения суммарной антиоксидантной активности пищевых продуктов и лекарственных препаратов на основе растительного сырья с использованием индикаторной системы Fe(III)/Fe(II)−о-фенантролин.
Проведена метрологическая аттестация методик определения антиоксидантной активности вин и лекарственных растений. Методика апробирована на образцах вина, пива, соков, чая, лекарственных трав и настоек.
На защиту выносятся
спектрофотометрический способ оценки интегральной (суммарной) антиоксидантной способности растительного сырья и пищевых продуктов на его основе;
результаты определения антиоксидантной способности индивидуальных восстановителей с учетом их химической структуры;
результаты анализа смесей восстановителей органической природы для оценки суммарного характера величины АОА;
результаты определения суммарной антиоксидантной способности некоторых пищевых продуктов для оценки их экологической безопасности и качества;
результаты исследований по влиянию экологической ситуации территории на величину антиоксидантной активности растительных материалов.
Апробация работы. Основные результаты работы доложены на Всероссийской конференции по аналитической химии «Аналитика России 2004» (Москва, 2004 г.), II международном симпозиуме «Разделение и концентрирование в аналитической химии и радиохимии» (Краснодар, 2005 г.), заключительной конференции грантодержателей регионального конкурса РФФИ и администрации Краснодарского края «р2003юг» (Краснодар, 2005 г.), международном конгрессе по аналитической химии «ICAS – 2006» (Москва, 2006 г.), Всероссийской конференции молодых ученых и II школы им. Н.М. Эммануэля «Окисление, окислительный стресс, антиоксиданты» (Москва, 2006 г.), международной научной конференции «Химия, химическая технология и биотехнология на рубеже тысячелетий» (Томск, 2006 г.).
Публикации. По материалам диссертации опубликованы 4 статьи и тезисы 6 докладов, получен патент РФ.
Структура и объем работы. Работа состоит из введения, обзора литературы, экспериментальной части и обсуждения результатов, выводов, списка цитируемой литературы, приложения. Диссертационная работа изложена на 178 страницах, содержит 46 таблиц, 7 рисунков и библиографию из 170 наименований.
Во введении раскрыта актуальность темы, определены цели и задачи исследования, сформулированы научная новизна и практическая значимость работы.
В литературном обзоре (глава 1) дана классификация и охарактеризованы основные группы антиоксидантов. Рассмотрены способы определения активности индивидуальных антиоксидантов и суммарной антиоксидантной способности растительного сырья и пищевых продуктов.
Во второй главе представлены данные об используемых методах и приборах, описаны условия эксперимента, изложены результаты с обсуждением.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1 Исследование системы Fe(III)/Fe(II)−о-фенантролин для оценки антиоксидантной способности природных объектов
Анализ литературных данных показал, что существующие в настоящее время методы определения антиоксидантной активности в большинстве случаев основаны на способности антиоксидантов взаимодействовать со свободными радикалами. Для оценки антиоксидантной активности индивидуальных веществ и реальных объектов обычно используют радикалы, образующиеся в процессе окисления липидсодержащих субстратов либо генерируемые в различных системах (Fe(III) – H2O2, гипоксантин – ксантин оксидаза, пероксидаза хрена – H2O2) радикалы OH˙, O˙ֿ2
Методы, основанные на ингибировании антиоксидантами окисления липидов, дают более достоверные результаты, поскольку характеризуют способность исследуемого объекта подавлять свободнорадикальные окислительные процессы в организме. Однако данные методы являются длительными и трудоемкими, а полученные результаты плохо воспроизводимы и зависят от многих параметров: природы окисляемого субстрата, концентрации инициатора, начальной скорости окисления.
Антиоксидантное действие большинства биологически активных соединений связано с их способностью легко окисляться, отдавая электрон или атом водорода, что положено в основу определения индивидуальных восстановителей по их воздействию на окислительно-восстановительную систему, содержащую комплексные соединения ионов переходных металлов: Fe(III) – 2, 2′ дипиридил, Fe(III) – трипиридил-триазин, Fe(III) – ферроцин, Cu(II) – неокупроин, Ru – 2, 2′ дипиридил.
Введение в окислительно-восстановительную систему Fe(III)/Fe(II) органического лиганда – о-фенантролина увеличивает величину стандартного редокс-потенциала полуреакции [Fe(Phen)3]+3 + ē D [Fe(Phen)3]+2 до E° = 1,10 В, расширяя круг определяемых веществ. Следует также отметить, что способность органического лиганда образовывать с восстановленной формой железа устойчивый в широком диапазоне рН (2 – 9) окрашенный хелат со значительным молярным коэффициентом поглощения (ε = 11100) создает условия для высокочувствительного и селективного определения. Это позволяет использовать систему Fe(III)/Fe(II)−о-фенантролин для определения антиоксидантной способности биологически активных соединений.
Окислительно-восстановительная способность выбранной индикаторной системы и чувствительность определения зависят от количества и соотношения Fe(III) и о-фенантролина, которые целесообразно вводить в реакцию совместно в виде комплексного реагента.
Оптимизацию состава реагента проводили методом многофакторного планирования эксперимента, который позволил выделить и оценить эффект, вызываемый каждым изучаемым фактором в отдельности. Факторами выступали – концентрация Fe(III), о-фенантролина и объем реагента, вводимый в реакцию с восстановителем. В качестве восстановителя выбрана аскорбиновая кислота, ввиду ее высокого окислительно-восстановительного потенциала и возможного присутствия в предполагаемых объектах исследования. Границы варьирования уровней факторов определялись шириной диапазона линейности зависимости аналитического сигнала от концентрации аскорбиновой кислоты (0,05 – 2,0 мкг/см3), с одной стороны, и достаточной чувствительностью и устойчивостью аналитического сигнала во времени, с другой.
Для каждого состава реагента, по уравнениям регрессии, была рассчитана величина аналитического сигнала при концентрации аскорбиновой кислоты 1,2 мкг/см3 и подобран объем, при котором значение аналитического сигнала максимально. Дальнейшие расчеты позволили заключить, что оптимальным является реагент состава: 0,006 М Fe(III) – 0,01 М о-фенантролина, при его объеме, вводимом в реакцию 1,0 см3 на 100 см3 раствора.
Для доказательства суммарного характера определяемой величины АОА рассматривалось влияние восстановителей органической природы и их суммы на индикаторную систему.
Изучено влияние ряда индивидуальных восстановителей на систему Fe(III)–о-фенантролин оптимального состава. Для исследования выбраны широко распространенные в растительном сырье, материалах и используемые в пищевой промышленности антиоксиданты фенольной (галловая кислота, кверцетин, рутин, танин, гидрохинон) и нефенольной (аскорбиновая кислота, цистеин, глутатион) природы.
Аналитический сигнал для перечисленных органических соединений линейно зависит от концентрации вещества в широком диапазоне, но не стабилен во времени. Это приводит к увеличению зависимого коэффициента в уравнении регрессии при сохранении линейности в том же диапазоне (таблица 1). Величина тангенса угла наклона зависимости аналитического сигнала от концентрации восстановителя изменяется от 0,01 для глутатиона до 0,5 для галловой кислоты, что объясняется различной антиоксидантной способностью изучаемых восстановителей. По уменьшению антиоксидантной активности их можно расположить в следующей последовательности: галловая кислота > кверцетин > гидрохинон > аскорбиновая кислота > танин > рутин > цистеин > глутатион. Антиоксидантная активность обусловлена числом и расположением функциональных групп, способных легко отдавать атом водорода (–OH, –SH, –NH), наличием сопряженных двойных связей, а также пространственной структурой молекул. Так, кверцетин, который имеет две 3' и 4' гидроксильные группы в орто-положении кольца В и одну в 3 положении кольца С является более эффективным антиоксидантом, чем его гликозид рутин, активная 3 – OH группа которого замещена сахарным остатком (рутинозой). Кроме того, наличие гликозидного остатка приводит к изменению пространственного расположения молекулы, что также является причиной более низкой антиоксидантной способности гликозидов по сравнению с агликонами. Различие в восстановительной способности цистеина и трипептида глутатиона, по-видимому, также обусловлено пространственной структурой их молекул.
Таблица 1 – Зависимость аналитического сигнала от концентрации восстановителя во времени
| Восстановитель | τ, мин | Уравнения регрессии | R2 | Диапазон линейности, мкг/см3 |
| Аскорбиновая кислота | y = 0,2306x + 0,0037 | 0,9993 | 0,05 – 1,8 | |
| y = 0,2465x + 0,0012 | 0,9996 | |||
| y = 0,2603x + 0,0013 | 0,9994 | |||
| y = 0,2713x – 0,0004 | 0,9991 | |||
| Танин | y = 0,1408x + 0,0028 | 0,9992 | 0,1 – 2,0 | |
| y = 0,1807x + 0,0009 | 0,9997 | |||
| y = 0,2118x + 0,0008 | 0,9991 | |||
| y = 0,2305x + 0,0039 | 0,9987 | |||
| Рутин | y = 0,1006x – 0,0011 | 0,9993 | 0,1 – 2,0 | |
| y = 0,1294x – 0,0016 | 0,9996 | |||
| y = 0,1535x – 0,0025 | 0,9997 | |||
| y = 0,1682x – 0,0024 | 0,9997 | |||
| Кверцетин | y = 0,3524x – 0,0018 | 0,9991 | 0,02 – 0,8 | |
| y = 0,4390x – 0,0043 | 0,9987 | |||
| y = 0,4852x – 0,0046 | 0,9986 | |||
| y = 0,5156x – 0,0044 | 0,9983 | |||
| Галловая кислота | y = 0,5201x – 0,0026 | 0,9995 | 0,02 – 0,8 | |
| y = 0,5817x – 0,0003 | 0,9991 | |||
| y = 0,6304x – 0,0003 | 0,9989 | |||
| y = 0,6642x + 0,0003 | 0,9986 | |||
| Гидрохинон | y = 0,3481x + 0,0105 | 0,9993 | 0,05 – 1,4 | |
| y = 0,3517x + 0,0078 | 0,9993 | |||
| y = 0,3522x + 0,0063 | 0,9994 | |||
| y = 0,3530x + 0,0061 | 0,9995 | |||
| y = 0,3541x + 0,0059 | 0,9994 | |||
| y = 0,3552x + 0,0051 | 0,9992 | |||
| Цистеин | y = 0,0847x – 0,0075 | 0,9967 | 0,1 – 2,0 | |
| y = 0,1141x – 0,0051 | 0,9992 | |||
| y = 0,1301x – 0,0024 | 0,9997 | |||
| y = 0,1394x – 0,0001 | 0,9998 | |||
| Глутатион | y = 0,0107x – 0,0016 | 0,9880 | 1,0 – 20 | |
| y = 0,0168x – 0,0022 | 0,9921 | |||
| y = 0,0212x – 0,0024 | 0,9959 | |||
| y = 0,0243x – 0,0022 | 0,9978 |
Реальные объекты представляют собой довольно сложные по химическому составу системы, антиоксидантные свойства которых реализуются за счет суммарного содержания и действия восстановителей различной природы. Как правило, в растительных природных объектах и пищевых продуктах одновременно содержатся фенольные соединения, витамины, моно- и полисахариды, органические и аминокислоты. Кроме того, при оценке антиоксидантной способности необходимо учитывать не только природу и содержание восстановителей в исследуемом объекте, но и возможность их взаимного влияния (например, синергизм или антагонизм).
Для сравнения антиоксидантной активности различных восстановителей, их смесей и реальных объектов целесообразно выражать эту величину количеством вещества-стандарта, как принято при определении многих известных суммарных показателей. В качестве вещества-стандарта при определении АОА предложено использовать аскорбиновую кислоту (АК), поскольку установлено, что она по антиоксидантной способности занимает промежуточное положение среди изучаемых восстановителей.
Для подтверждения суммарного характера определяемой величины антиоксидантной активности изучено влияние модельных смесей, содержащих восстановители в различных соотношениях на индикаторную систему Fe(III)/Fe(II)−о-фенантролин. Расчет теоретической величины АОА, в пересчете на вещество-стандарт, проводили по уравнениям количественного соответствия, показывающим связь между количеством вещества-стандарта и восстановителя в условиях равной антиоксидантной активности. Экспериментальные значения АОА рассчитывали, подставляя величину аналитического сигнала модельной смеси в усредненное уравнение регрессии зависимости аналитического сигнала от количества аскорбиновой кислоты. Результаты анализа модельных смесей представлены в таблице 2.
Как видно из таблицы 2, экспериментально полученные и теоретически рассчитанные величины АОА хорошо согласуются. Несколько завышенные результаты для моделей, содержащих аскорбиновую кислоту, вероятно, можно объяснить проявлением ею синергетических свойств. Полученные данные показывают, что определяемая величина – антиоксидантная активность – результат совместного действия всех присутствующих в модельной смеси восстановителей.
Таким образом, определяемый показатель является интегральным и индикаторная система Fe(III)/Fe(II)−о-фенантролин может быть использована при разработке способа оценки суммарной антиоксидантной активности растительного сырья и пищевых продуктов.
Таблица 2 – Результаты анализа модельных смесей (τ = 60 мин)
(n = 6, P = 0,95)
| Количество компонентов в смеси, мкг | Теоретическое значение АОА, мкг АК | Экспериментальное значение АОА, мкг АК | |||||||||
| введено | в пересчете на АК | ||||||||||
| АК | танин | рутин | кверцетин | цистеин | АК | танин | рутин | кверцетин | цистеин | ||
| − | − | − | 14,66 | 9,85 | 35,59 | − | 60,10 | 59 ± 5 | |||
| − | − | − | 7,33 | 4,92 | 17,79 | − | 30,04 | 27 ± 2 | |||
| − | − | − | 36,65 | 4,92 | 17,79 | − | 59,36 | 52 ± 5 | |||
| − | − | − | 7,33 | 24,63 | 17,79 | − | 49,75 | 51 ± 4 | |||
| − | − | − | 7,33 | 4,92 | 89,02 | − | 101,27 | 98 ± 8 | |||
| − | − | − | 21,99 | 4,92 | 17,79 | − | 44,70 | 38 ± 6 | |||
| − | − | − | 7,33 | 14,78 | 3,41 | − | 75,52 | 77 ± 9 | |||
| − | 14,66 | 9,85 | 35,59 | − | 80,10 | 97 ± 9 | |||||
| − | 7,33 | 4,92 | 17,79 | − | 80,04 | 85 ± 10 | |||||
| − | 36,65 | 4,92 | 17,79 | − | 69,36 | 74 ± 10 | |||||
| − | 7,33 | 24,63 | 17,79 | − | 59,75 | 80 ± 11 | |||||
| − | 7,33 | 4,92 | 89,02 | − | 111,27 | 129 ± 12 | |||||
| − | 21,99 | 4,92 | 17,79 | − | 74,70 | 81 ± 8 | |||||
| − | 7,33 | 14,78 | 53,41 | − | 85,52 | 108 ± 10 | |||||
| − | − | − | − | − | 4,60 | 24,60 | 22 ± 2 | ||||
| − | − | − | − | − | 9,23 | 19,23 | 17 ± 2 |
2 Разработка способа оценки антиоксидантной способности природных объектов
Проведенные нами исследования показали, что аналитические сигналы в индикаторной системе Fe(III)/Fe(II)−о-фенантролин меняются во времени в зависимости от концентрации как индивидуальных восстановителей и их смесей, так и реальных объектов. Это приводит к необходимости строгого контроля времени эксперимента, что делает его длительным, трудоемким, ухудшаются также метрологические характеристики анализа. Устранение этого недостатка и стабилизация аналитического сигнала требуют оптимизации условий протекания реакции. Для решения поставленной задачи рассматривались различные способы воздействия на реакцию, протекающую в системе: повышение температуры и введение в реакционную смесь реагентов, традиционно используемых для связывания ионов Fe+3 (фторида натрия, ЭДТА).
Влияние перечисленных параметров изучалось на примере реакции окисления аскорбиновой кислоты, концентрацию которой варьировали в установленных пределах диапазона линейности.
Исследование влияния температуры проводили в интервале 25 –60 °С. Нижняя граница диапазона соответствует нормальным условиям протекания окислительно-восстановительных процессов, а верхняя обусловлена неустойчивостью аскорбиновой кислоты при температурах выше 50 °С. Установлено, что при выдерживании реакционной смеси в течение 60 мин при температуре ~ 50 °С наблюдается стабилизация аналитического сигнала во времени. Это, вероятно, связано с более быстрым и полным протеканием реакции. Однако при анализе в этих условиях реальных объектов существенной стабилизации аналитического сигнала не наблюдается.
Для стабилизации аналитического сигнала путем вывода из реакции не прореагировавших ионов Fe+3 в реакционную смесь вводили «стоп-реагент», в качестве которого применяли комплексообразователи: фторид натрия и ЭДТА в диапазоне концентраций 0,06 мМ – 0,01 М, 0,03 мМ – 0,1 мМ соответственно.
В ходе эксперимента установлено, что введение в реакционную систему более 0,05 мМ ЭДТА приводит к уменьшению во времени аналитического сигнала аскорбиновой кислоты и (или) фенольных антиоксидантов, используемых в качестве восстановителя. Введение ЭДТА в меньших концентрациях приводит к получению стабильного во времени аналитического сигнала для индивидуальных восстановителей, однако при этом не стабилизируется сигнал реальных объектов.
Для большинства изучаемых восстановителей введение в реакцию 0,01 М фторида натрия обеспечивает стабильный во времени аналитический сигнал (таблица 3). В случае танина и рутина наблюдается незначительное нарастание аналитического сигнала во времени.
В аналогичных условиях были получены стабильные во времени аналитические сигналы для реальных объектов, таких как сухое вино, пиво, соки, чай, экстракты лекарственных растений. Это позволило рекомендовать фторид натрия в качестве «стоп-реагента» при определении антиоксидантной активности растительного сырья и пищевых продуктов.
Таблица 3 – Зависимость аналитического сигнала восстановителя от его концентрации во времени в присутствии 0,01 М NaF *
| Восстановитель | τ, мин | Уравнения регрессии | R2 |
| Аскорбиновая кислота | y = 0,2619x – 0,0032 | 0,9996 | |
| y = 0,2624x – 0,0035 | 0,9996 | ||
| y = 0,2626x – 0,0024 | 0,9996 | ||
| y = 0,2628x – 0,0032 | 0,9996 | ||
| Танин | y = 0,1871x + 0,0012 | 0,9999 | |
| y = 0,1917x + 0,0009 | 0,9997 | ||
| y = 0,1963x + 0,0019 | 0,9998 | ||
| y = 0,2013x + 0,0038 | 0,9997 | ||
| Рутин | y = 0,1301x – 0,0012 | 0,9999 | |
| y = 0,1327x – 0,0002 | 0,9999 | ||
| y = 0,1384x – 0,0004 | 0,9999 | ||
| y = 0,1425x + 0,0017 | 0,9999 | ||
| Кверцетин | y = 0,3813x – 0,0012 | 0,9986 | |
| y = 0,3818x – 0,0010 | 0,9982 | ||
| y = 0,3826x – 0,0005 | 0,9983 | ||
| y = 0,3837x – 0,0006 | 0,9983 | ||
| Галловая кислота | y = 0,5537x + 0,0030 | 0,9987 | |
| y = 0,5546x + 0,0032 | 0,9986 | ||
| y = 0,5557x + 0,0036 | 0,9986 | ||
| y = 0,5563x + 0,0026 | 0,9986 | ||
| Гидрохинон | y = 0,3531x + 0,0049 | 0,9996 | |
| y = 0,3535x + 0,0048 | 0,9997 | ||
| y = 0,3541x + 0,0043 | 0,9996 | ||
| y = 0,3543x + 0,0045 | 0,9997 | ||
| Цистеин | y = 0,0993x – 0,0068 | 0,9976 | |
| y = 0,0997x – 0,0066 | 0,9980 | ||
| y = 0,1004x – 0,0065 | 0,9985 | ||
| y = 0,1004x – 0,0065 | 0,9982 | ||
| Глутатион | y = 0,0168x – 0,0021 | 0,9928 | |
| y = 0,0168x – 0,0023 | 0,9930 | ||
| y = 0,068x – 0,0024 | 0,9927 | ||
| y = 0,0168x – 0,0023 | 0,9930 |
* «стоп-реагент» вводился в реакционную смесь через 60 мин после начала реакции
Проведенная оптимизация условий определения АОА: состав и объем вводимого комплексного реагента, выбранный комплексообразователь и его концентрацию, а также время выдерживания до и после введения «стоп-реагента», позволил предложить алгоритм методики определения антиоксидантной активности растительных материалов и пищевых продуктов. Комплексный реагент состава 6 мМ Fe(III) и 10 мМ о-фенантролина смешивают с исследуемым образцом (разбавление и объем которого будут зависеть от его антиоксидантной активности), выдерживают фиксированное время, по истечение которого реакцию останавливают добавлением «стоп-реагента» и через установленное время измеряют оптическую плотность испытуемого раствора при характеристической длине волны. Антиоксидантную активность пищевых продуктов и растительного сырья выражают количеством вещества-стандарта (аскорбиновой кислоты), производящим антиоксидантный эффект, эквивалентный действию суммы восстановителей изучаемого образца (в мг аскорбиновой кислоты на г (см3) продукта).
Различные группы пищевых продуктов отличаются по химическому составу и, в том числе, по содержанию восстановителей, поэтому их антиоксидантные свойства могут сильно отличаться. Это приводит к необходимости оптимизации условий определения антиоксидантной активности реальных объектов. Кроме того, известно, что разбавление может привести к изменению вещественного состава образца, в частности, за счет протекания реакций гидролиза.
Оптимизацию определения антиоксидантной активности проводили на образцах пищевых продуктов по единой методологии, заключающейся в рассмотрении изменения аналитического сигнала пробы при различном разбавлении и времени выдерживания до введения в реакцию. Критериями оптимальности служили неизменность аналитического сигнала после разбавления пробы при ее выдерживании в течение 60 мин, стабильный в течение длительного времени (до 120 мин) аналитический сигнал после введения «стоп-реагента», а также пропорциональное изменение сигналов при разбавлении.
Так, например, для образцов вина, разбавленных менее чем в 100 раз, наблюдается уменьшение аналитического сигнала пробы в среднем на 12 % при выдерживании в течение часа. При введении в реакцию разбавленных в соотношении 1:100 и 1:200, а также неразбавленных (вводимый объем 0,02 см3) образцов аналитический сигнал стабилен после введения «стоп-реагента» и пропорционально возрастает с увеличением объема пробы.
Проведенные исследования для различных групп пищевых продуктов позволили оптимизировать разбавление и объем пробы, вводимый в реакцию (таблица 4), и рекомендовать внесение ее сразу после разбавления.
По разработанной методике были проанализированы сухие красные и белые вина, пиво, восстановленные и свежеотжатые фруктовые соки, чай и растительное сырье (таблица 5). Полученные результаты показывают, что величина их антиоксидантной активности варьируется в широком диапазоне.
Таблица 4 – Оптимизированные разбавление и объем пробы, вводимой в реакцию
| Объект исследования | Разбавление образца | Объем пробы, вводимый в реакцию, см3 |
| Вино | 1: 100, 1: 200 | 1,0 – 2,0 |
| Пиво | 1: 20 | 1,0 – 2,5 |
| Сок | 1: 5 | 0,2 – 1,0 |
| Чай | 1: 50, 1: 100 | 1,0 – 2,0 |
Таблица 5 – Антиоксидантная активность ряда образцов растительного сырья и пищевых продуктов (n = 6, P = 0,95)
| Объект исследования | Характеристика объекта | АОА, мгАК/г |
| Сухие вина: | ||
| Каберне Фанагории | ОАО АПФ «Фанагория» | 3,7 ± 0,1 |
| Каберне Абрау | вино невыдержанное ООО «Кубань – Вино» | 2,3 ± 0,1 |
| Каберне | ООО «Мильстрим – Черноморские вина» | 2,0 ± 0,1 |
| Каберне | ООО «Инвинком», Молдова | 2,0 ± 0,1 |
| Мускат | ООО «Инвинком», Молдова | 0,29 ± 0,05 |
| Шардоне | ЗАО Агрофирма «Мысхако» | 0,23 ± 0,02 |
| Пиво: | ||
| Балтика №3 | светлое, ОАО «Пивоваренная компания «Балтика» | 0,21 ± 0,01 |
| Балтика №6 | темное, ОАО «Пивоваренная компания «Балтика» | 0,50 ± 0,01 |
| Чай: | ||
| Майский | сорт высший, ООО «Май» | 134 ± 7 |
| Краснодарский | сорт второй, ЗАО «Дагомысчай» | 60 ± 3 |
| Соки восстановленные: | ||
| Яблочный | ОАО «Лебедянский» | 0,51 ± 0,04 |
| Апельсиновый | ОАО «Лебедянский» | 2,2 ± 0,2 |
| Растительное сырье: | ||
| крапива | ОАО «Красногорсклексредства» | 21 ± 1 |
| эхиноцея пурпурная | ОАО «Красногорсклексредства» | 28 ± 1 |
3 Антиоксидантная активность пищевых продуктов как обобщающая характеристика показателя их качества
Представляло интерес сопоставить известные суммарные показатели конкретных пищевых продуктов, характеризующие их восстановительные свойства, с величиной АОА, определяемой по разработанной методике.
Для ряда пищевых продуктов можно выделить преобладающую группу восстановителей органической природы. Например, антиоксидантные свойства вина в основном обусловлены фенольными соединениями, включающими катехины, антоцианы, флавонолы, лейкоантоцианы, танины, пива – водорастворимыми компонентами солода и хмеля (экстрактивными веществами). Основной вклад в величину антиоксидантной активности чая, вероятно, вносят полифенольные соединения (танины). Кроме того, в чае присутствуют замещенные фенолы (галловая кислота, кверцетин, рутин), способные взаимодействовать с индикаторной системой Fe(III)/Fe(II)−о-фенантролин. Это и обусловило выбор объектов исследования – сухое красное вино, пиво, чай – для проведения сопоставительного анализа.
Было определено суммарное содержание фенольных соединений в сухих красных винах спектрофотометрическим методом с использованием реактива Фолина – Чокальтеу и суммы экстрактивных веществ пива и чая в соответствии с ГОСТ 12787-81 и 28851-90. Установлена взаимосвязь между суммарной антиоксидантной активностью и этими показателями. Зависимость между антиоксидантной активностью и содержанием экстрактивных веществ для образцов, на примере пива, приведена на рис. 1. Для образцов вина наблюдается не только взаимосвязанное изменение антиоксидантной активности и концентрации фенольных соединений, но и довольно близкие значения этих суммарных показателей (таблица 6).
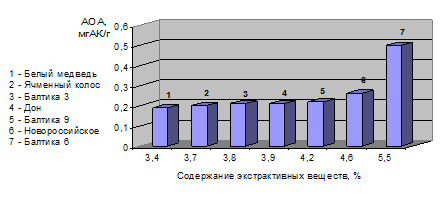
Рис. 1 – Взаимосвязь антиоксидантной активности и суммы экстрактивных веществ пива
Таблица 6 – Результаты определения суммарных показателей вин (n = 6, P = 0.95)
| Объект исследования | Суммарное содержание фенольных соединений, мг/см3 | АОА, мгАК/см3 |
| Каберне Фанагории, производитель ОАО АПФ «Фанагория» | 3,6 ± 0,3 | 3,7 ± 0,1 |
| Каберне Абрау (невыдержанное), производитель ООО «Кубань – Вино», | 1,9 ± 0,1 | 2,3 ± 0,1 |
| Каберне, производитель ООО «Мильстрим – Черноморские вина» | 1,9 ± 0,1 | 2,0 ± 0,1 |
| Каберне, производитель ООО «Инвиком» | 1,7 ± 0,2 | 2,0 ± 0,1 |
| Каберне (1)* | 1,3 ± 0,1 | 1,3 ± 0,1 |
| Каберне (2)* | 1,4 ± 0,2 | 1,4 ± 0,1 |
| Каберне (3)* | 1,5 ± 0,2 | 1,5 ± 0,1 |
| Каберне (4)* | 0,7 ± 0,1 | 0,83 ± 0,06 |
| Русская лоза (купаж), производитель ЗАО «Русская лоза» | 1,9 ± 0,2 | 2,3 ± 0,1 |
| Каберне (эталон) | 2,7 ± 0,2 | 2,6 ± 0,1 |
| Каберне (виноматериал) | 2,1 ± 0,2 | 2,4 ± 0,1 |
| Мерло, производитель ООО «Тамань-Агро» | 2,6 ± 0,2 | 2,8 ± 0,2 |
| Мерло, производитель ООО «Инвиком» | 2,1 ± 0,2 | 2,4 ± 0,1 |
| Изабелла, производитель ООО «Бостован» | 1,6 ± 0,2 | 1,5 ± 0,1 |
| Изабелла (эталон) | 1,1 ± 0,1 | 0,69 ± 0,03 |
*образцы вин Каберне хранились длительное время после откупоривания.
Наблюдаемая взаимосвязь между АОА исследуемых образцов и другими суммарными показателями подтверждает интегральный характер разработанного показателя – антиоксидантной активности.
Особенностью фруктовых соков является отсутствие доминирующей группы восстановителей органической природы. В связи с этим, было изучено влияние ряда веществ, входящих в состав сока: аскорбиновой и яблочной кислот, витамина В1, глюкозы, фруктозы и сахарозы на индикаторную систему Fe(III)/Fe(II)–о-фенантролин. При выборе диапазона исследуемых концентраций восстановителей ориентировались на их содержание в реальных образцах.
Установлено, что сахара: глюкоза, фруктоза и сахароза с индикаторной системой не реагируют и вклада в антиоксидантную активность сока не вносят. Аскорбиновая, яблочная кислоты и витамин В1 дают значимые аналитические сигналы при реакции с комплексным реагентом в диапазонах концентраций 0,05 – 1,8; 2,0 – 10; 10 – 400 мкг/см3 соответственно.
Антиоксидантную активность пищевых продуктов возможно сопоставлять с величиной ванадатной окисляемости, характеризующей способность образца восстанавливать ванадий (V) в кислой среде, что наиболее целесообразно, если в объекте сложно выделить доминирующую группу восстановителей. Однако сравнение можно провести только на качественном уровне путем построения рядов или диаграмм, ввиду того, что анализируемые величины имеют разное выражение единиц измерений.
Была определена ванадатная окисляемость разных групп пищевых продуктов – сока, пива, чая. Установлено, что последовательность расположения анализируемых образцов, относящихся к одному виду пищевых продуктов, по величинам антиоксидантной активности и ванадатной окисляемости одинакова. Это является качественным доказательством правильности разработанной методики. Диаграмма качественного соответствия для образцов пищевых продуктов, на примере пива, представлена на рис. 2.
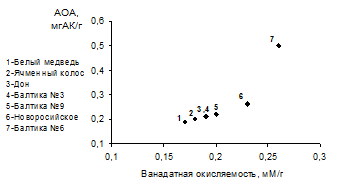
Рис. 2 – Оценка качественного соответствия АОА и ванадатной окисляемости для пива
Анализ многочисленных проб сухих красных и белых вин разных производителей показал, что антиоксидантная способность красных вин группы «Каберне», «Мерло», «Изабелла» примерно на порядок выше, чем белых вин группы «Шардоне» и «Мускат». Это можно объяснить более высоким содержанием в красных винах фенольных соединений, особенно катехинов, танина и красящих веществ – антоцианов. Кроме того, по показателю антиоксидантной активности, вероятно, можно отделить вина группы «Изабелла» (0,7 – 1,5 мгАК/см3) от «Мерло» и «Каберне» (2,3 –3,7 мгАК/см3), а «Мускатные» (около 0,3 мгАК/см3) от «Шардоне» (около 0,2 мгАК/см3).
Для светлых сортов пива: «Белый медведь», «Ячменный колос», «Балтика №