Для увеличения выхода продуктов данной химической реакции необходимо смещение химического равновесия в сторону продуктов реакции. Применим принцип Ле-Шателье.
1) увеличить температуру системы, т.к. процесс эндотермический
(∆ r H0 Т > 0), в соответствии с изобарой Вант-Гоффа:
(dlnKp / dT) = ∆ r H0Т /(RT 2);
2) увеличить концентрацию (парциальное давление) исходного газа СО2 - дополнительный ввод газа;
снижать концентрацию (парциальное давление) продукта реакции СО – отводить газ из сферы реакции;
3) понизить общее давление в системе, т.к. прямая реакция идет с увеличением числа молей газообразных веществ.
ЗАДАЧА 4. Химическая кинетика.
Для заданной химической реакции nА + mВ ® AnBm
| Т 1, К | Т 2, К | k 1 | k 2 | t, мин | С0, моль/л |
| 5 .10-5 л2×моль-2×с-1 | 2 .10-1 л2×моль-2×с-1 | 0,1 |
1. Рассчитайте энергию активации по значениям констант скорости реакции k 1 и k 2 при температурах Т 1 и Т 2, соответственно. Дайте определение и предложите способы изменения энергии активации.
Зависимость константы скорости реакции от температуры определяется уравнением Аррениуса:

где R = 8,31 Дж/(моль×К) – универсальная газовая постоянная.
Для заданной химической реакции:
ln(2 .10-1 / 5 .10-5) = Е акт . (400 - 330) / 8,31. 400 . 330, решаем уравнение и получаем: Е акт =130 кДж/моль.
Энергия активации – энергия, необходимая для перехода реагирующих частиц в состояние активированного комплекса. Энергию активации можно уменьшить с помощью катализатора.
2. Определите количество вещества (моль/л), израсходованного за указанное время t при температуре Т 2 , если начальная концентрация реагентов одинакова и равна С0.
По размерности константы скорости химической реакции,
[ k ] = [л2×моль-2×с-1], определяем порядок химической реакции: n =3.
Изменение концентрации исходных веществ по времени при одинаковой начальной концентрации исходных веществ для реакции третьего порядка рассчитывается по уравнению:

где с – текущая концентрация веществ в момент времени τ,
с0 – начальная концентрация веществ, k – константа скорости,
τ – время.
Рассчитаем текущую концентрацию исходных веществ с в момент времени τ =30мин =1800 сек при температуре 400 К,
k 2= 2 .10-1 л2×моль-2×с-1:

 ,
,
решаем уравнение и получаем: с = 0,035 моль/л.
Количество вещества (моль/л), израсходованного за 30 минут при температуре 400 К:
Δ с = с 0 - с = 0,1- 0,035= 0,065 моль/л.
Рассчитайте период полупревращения для вашей реакции при температуре
Т 2. Определите, от каких факторов зависит период полупревращения для вашей реакции.
Рассчитаем период полупревращения τ 1/2 для реакции 3-го порядка при температуре 400 К.

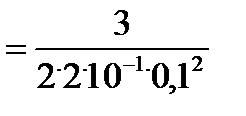 = 750 сек.
= 750 сек.
Для реакции 3-го порядка период полупревращения зависит от температуры, природы и концентрации реагентов.
ПРИЛОЖЕНИЕ
Таблица. Термодинамические характеристики некоторых веществ
| вещество | ∆ Н 0298, кДж/моль | D G 0298, кДж/моль | S 0298, Дж/моль.К | с0р, 298 Дж/моль.К |
| Cd | 51,76 | |||
| CdCl2 | -256,1 | -342,6 | 115,3 | |
| Co | 30,04 | 24,6 | ||
| CoO | -239 | - | 52,7 | 78,6 |
| CoCl2 | -310 | -267 | 109,6 | - |
| Cu | 33,3 | 24,51 | ||
| CuO | -165,3 | -127 | 42,64 | 44,78 |
| CuCl2 | -205,9 | -166,1 | - | |
| СО2 (г) | -393,51 | -394,38 | 213,68 | 37,41 |
| Cr | 23,76 | 23,35 | ||
| CrCl3 | -554,8 | 122,9 | 91,8 | |
| Сl2 (г) | 222,96 | 33,93 | ||
| Fe | 27,15 | 24,98 | ||
| FeO | -263,7 | -244,3 | 58,79 | 49,92 |
| Fe2O3 | -821,32 | -741,5 | 89,96 | 48,12 |
| FeS | -100,5 | -100,9 | 60,33 | |
| FeCl2 | -341 | -301,7 | 120,1 | |
| H2O (г) | -241,82 | -228,61 | 188,7 | 33,61 |
| Н2О (ж) | -285,84 | -237,2 | 70,08 | 89,33 |
| H2S (г) | -20,17 | -33,01 | 205,6 | 33,44 |
| Ni | 29,86 | 26,05 | ||
| NiO | -239,7 | -216,5 | 38,07 | 44,27 |
| NiS | -94,1 | - | 52,99 | |
| Mo | 28,58 | 23,75 | ||
| MoO2 | -589,3 | 46,51 | 55,91 | |
| O2 (г) | 205,04 | 29,37 | ||
| Pb | 64,9 | 26,82 | ||
| PbO2 | -276,6 | -219 | 76,44 | 62,89 |
| SO2 (г) | -296,9 | -300,4 | 248,1 | 39,87 |
| W | 32,76 | 24,8 | ||
| WO3 | -841,3 | - | 81,6 | 79,7 |
| V2O5 | -1557 | - | - | |
| V2O3 | -1219 | - | - | |
| Zn | 41,59 | 25,48 | ||
| ZnS | -201 | -239,8 | 57,7 | 46,02 |
| ZnO | -349 | -318,2 | 43,5 | 40,25 |
Таблица. Термодинамические характеристики некоторых веществ и ионов
| Вещество | Δ fН 0298, кДж/моль | ∆ fG 0298, кДж/моль | S 0298, Дж/моль.K | С 0 р 298 Дж/моль.К |
| Al(к) | 28,33 | 24,35 | ||
| Al2O3(к) | −1675,69 | −1582,27 | 50,92 | 79,04 |
| C(графит) | 5,74 | 8,54 | ||
| CO(г) | −110,53 | −137,15 | 197,55 | 29,14 |
| CO2(г) | −393,51 | −394,37 | 213,66 | 37,44 |
| COCl2(г) | −219,50 | −265,31 | 283,64 | 57,76 |
| CH4(г) | −74,85 | −50,79 | 186,19 | 35,71 |
| C2H2(г) | 226,75 | 209,2 | 200,8 | 43,93 |
| C2H4(г) | 52,28 | 68,11 | 219,4 | 43,56 |
| C2H6(г) | −84,68 | −32,89 | 229,5 | 52,64 |
| C3H8(г) | −104,0 | −23,49 | 269,9 | 73,51 |
| C6H6(г) | 82,93 | 269,2 | 81,67 | |
| CH3OH(ж) | −238,6 | −166,23 | 126,8 | 81,60 |
| CaO(к) | −635,5 | −604,2 | 39,7 | 42,05 |
| CaCO3(к) | −1207,1 | −1128,76 | 92,88 | 83,47 |
| Cl2(г) | 222,96 | 33,93 | ||
| Cu(к) | 33,14 | 24,43 | ||
| Cu2O(к) | −173,18 | −150,56 | 92,93 | 63,64 |
| CuSO4(к) | −770,90 | −661,79 | 109,2 | 98,87 |
| CuCl(к) | −133,6 | −116,0 | 91,2 | 48,53 |
| CuO(к) | −165,0 | −127,0 | 42,64 | 42,30 |
| Fe(к) | 27,15 | 24,98 | ||
| FeO(к) | −263,7 | −244,3 | 58,79 | 49,92 |
| Fe2O3(к) | −822,16 | −740,98 | 89,96 | 103,76 |
| H2(г) | 130,58 | 28,83 | ||
| HCl(г) | −92,3 | −95,27 | 186,69 | 29,14 |
| HI(г) | 25,94 | 1,3 | 206,3 | 29,16 |
| H2O(г) | −241,82 | −228,61 | 188,7 | 33,61 |
| H2O(ж) | −285,84 | −237,2 | 70,08 | 75,30 |
| H2O2(ж) | −187,8 | −120,4 | 109,6 | 89,33 |
| H2S(г) | −20,17 | −33,01 | 205,6 | 33,44 |
| I2(к) | 116,73 | 54,44 | ||
| I2(г) | 62,24 | 19,4 | 260,58 | 36,90 |
| KCl(к) | −435,9 | −408,3 | 82,7 | 51,49 |
| K(к) | 64,18 | 29,58 | ||
| LiOH(к) | −487,8 | −443,9 | 42,7 | 49,58 |
| Li2O(к) | −598,7 | −562,1 | 37,9 | 39,51 |
| Mg(к) | 32,55 | 24,89 | ||
| MgO(к) | −601,24 | −569,4 | 26,94 | 37,20 |
| MgCO3(к) | −1095,85 | −1012,12 | 65,10 | 76,11 |
| MgSO4(к) | −1287,42 | −1173,25 | 91,55 | 95,60 |
| Mg(OH)2(к) | −924,66 | −833,75 | 63,14 | 76,99 |
| Na(к) | 51,21 | 28,24 | ||
| NaCl(к) | −411,12 | −384,13 | 72,13 | 50,81 |
| NH3(г) | −46,19 | −16,66 | 192,5 | 35,16 |
| NO(г) | 90,37 | 86,71 | 210,62 | 29,86 |
| NO2(г) | 33,5 | 51,8 | 240,45 | 36,66 |
| N2O4(г) | 9,66 | 98,28 | 304,3 | 79,16 |
| O2(г) | 205,04 | 29,37 | ||
| PbO(к) | −219,28 | −189,10 | 66,11 | 45,81 |
| PbSO4(к) | −920,48 | −813,67 | 148,57 | 103,22 |
| PtCl4(к) | −229,28 | −163,80 | 267,88 | 150,86 |
| PtCl2(к) | −106,69 | −93,35 | 219,79 | 75,52 |
| S(к) | 31,88 | 22,68 | ||
| SO2(г) | −296,9 | −300,4 | 248,1 | 39,87 |
| SO3(г) | −395,2 | −370,4 | 256,23 | 50,09 |
| PCl3(г) | −287,02 | −267,98 | 311,71 | 71,84 |
| PCl5(г) | −374,89 | −305,10 | 364,47 | 112,97 |
| Ti(к) | 30,6 | 25,02 | ||
| TiO2(к) | −933,03 | −877,65 | 49,92 | 55,21 |
| Zn(к) | 41,59 | 25,44 | ||
| ZnO(к) | −349,0 | −318,2 | 43,5 | |
| ZnSO4(к) | −981,36 | −870,12 | 110,54 | 99,06 |
| Al3+(р) | −529,69 | −489,80 | ||
| Cd2+(р) | −75,31 | −77,65 | ||
| Fe2+(р) | −87,86 | −84,88 | ||
| Fe3+(р) | −47,70 | −10,54 | ||
| H+(р) | ||||
| Ni2+(р) | −53,14 | −45,56 | ||
| Pb2+(р) | 1,63 | −24,30 | ||
| Zn2+(р) | −153,64 | −147,16 |