Свое название белки этого семейства получили, во-первых, потому, что они принадлежат к суперсемейству Ras, а во- вторых, потому, что первые представители этой группы были изолированы из тканей мозга (Ra s-related proteins from b rain).
Rab-белки высококонсервативны и компартмент-специфичны, причем, как правило, каждый компартмент имеет целый набор Rab-белков. В настоящее время идентифицировано 11 генов в дрожжах (они в этом случае называются Ypt), и более 60 генов у млекопитающих, хотя место работы или функция известны далеко не для каждого Rab-белка.
Rab-белки являются классическими малыми ГТФазами, с высококонсервативным доменом, составляющим гуанин нуклеотид-связывающий карман, относительно небольшим гипервариабельным доменом, придающим специфичность каждой изоформе Rab-белка, и С-концевой последовательностью, модифицированной одним, а чаще двумя остатками геранил-геранильной кислоты, позволяющей белку заякориваться в мембране.
Rab-белки имеют свои наборы GEF и GAP, которые могут быть уникальными, а могут быть общими для нескольких Rab-белков. Так, например, везикулы с вновь синтезированными белками сливаются с АГ с помощью Rab1, а секреция (т. е. слияние с плазматической мембраной) регулируется Rab10 и Rab8 (а также Rab3 в случае синаптических везикул). Все эти белки активируются одним и тем же фактором обмена нуклеотидов Mss4, таким образом, весь секреторный путь работает координированно.
4.2.1. Первый цикл после синтеза de novo
Каждая клетка имеет свой спектр Rab-белков, поскольку наряду со свойственными любой клетке транспортными процессами в некоторых высокоспециализированных клетках возникает потребность в специфических путях, а в некоторых, наоборот, отпадает. Набор экспрессируемых Rab-белков может изменяться при дифференцировки. Rab-белки в принципе весьма долгоживущие протеины, однако если в ходе специализации с некоторыми из них приходится расставаться, то параллельно с выключением экспрессии соответствующего гена его уже синтезированные белковые продукты выводятся из игры с помощью полиубиквитинирования убиквитин-лигазами и последующей быстрой деградации с помощью протеасом (об убиквитинировании мы будем говорить в отдельной главе). Необходимый уровень Rab-белков поддерживается за счет синтеза de novo, в результате их внутриклеточный пул медленно обновляется. Rab-белки синтезируются на рибосомах в цитоплазме, и каждый «новорожденный» белок встречает так называемый белок эскорта (REP, Rab escort protein). Известны две изоформы REP - 1 и 2, при этом обе экспрессируются одновременно, но REP2 не может полностью заменить REP1 в случае его нокаута или негативной мутации. REP работает со всеми изоформами Rab-белков.
В первом цикле после синтеза Rab-белка (рис. 23) REP выполняет две функции. Во-первых, являясь субъединицей геранил-геранил-трансферазы (ГГТ), REP представляет новый Rab димеру, образованному альфа- и бета-субъединицами ГГТ, который к нему присоединяет остатки геранил-гераниловой кислоты. Далее димер диссоцирует, а REP в комплексе с уже модифицированным Rab-белком принимает такую конформацию, которая позволяет экранировать гидрофобные жирнокислотные хвосты от гидрофильного цитоплазматического окружения.
Во-вторых, REP доставляет уже изопренилированный Rab к «месту службы» (в литературе этот момент изящно называется «презентацией Rab-белка донорой мембране»), где сдает Rab-белок с рук на руки мембранному белку GDF (G DI d isplacement f actor), в результате Rab-белок встраивается в мембрану, где ему предстоит работать в дальнейшем.
|
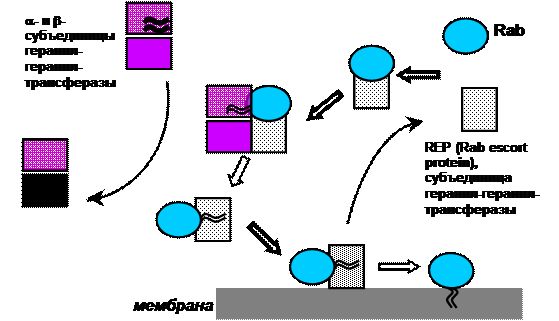
Рис. 23. Первый цикл Rab-белка после синтеза de novo
Вновь синтезированный Rab-белок может быть свободным от нуклеотида, а может и связывать ГДФ. Только по достижении «своей» мембраны возможен переход в ГТФ-связанное сосотояние.
4.2.2. Rab-белки в регуляции слияния мембран.
Рабочий цикл
Rab-белок ГТФ приобретает под действием специфичного для данной изоформы GEF (рис. 24). Далее активированный Rab-ГТФ встраивается в мембрану формирующегося (в некоторых случаях – уже сформированного) транспортного пузырька за счет взаимодействия либо с элементами окаймления, либо с рецепторами грузов, либо с v-SNARE. Активированный Rab-белок едет на уже потерявшей окаймление везикуле к мембране-мишени и после слияния мембран оказывается в составе мембраны-акцептора.
Первоначально предполагали, что гидролиз ГТФ на Rab-белке может стимулировать слияние мембран, однако впоследствии оказалось, что отщепление фосфатной группы происходит уже после слияния, и GAP работает на акцепторной мембране.
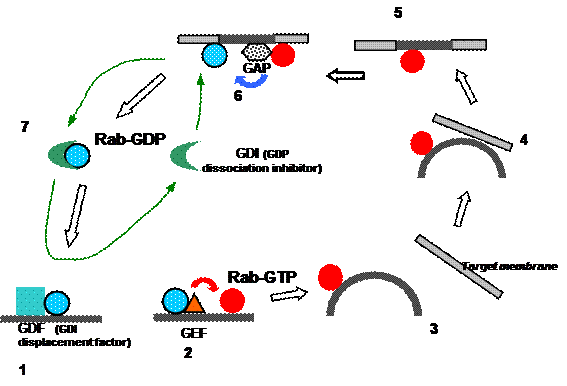
Рис. 24. Рабочий цикл Rab-белка при слиянии мембран
После гидролиза ГТФ Rab образует комплекс с белком GDI (G DP d issociation i nhibitor). Из названия следует, что GDI препятствует уходу ГДФ с Rab-белка. Таким образом, GDI является еще одним уровнем контроля динамики оборота нуклеотидов на малой ГТФазе, поскольку, учитывая высокую внутриклеточную концентрацию ГТФ (10 мкМ), без специального экранирования место связывания нуклеотида было бы быстро занято ГТФ, и белок снова перешел бы в активное состояние. Далее GDI экстрагирует Rab-ГДФ из мембраны-акцептора и переносит его через цитоплазму обратно к мембране-донору. Там он вставляет Rab в тот сайт донорной мембраны, где локализован уже упоминавшийся вначале GDF – фактор замещения GDI. GDI высвобождается в цитоплазму, а Rab возвращается в исходное состояние. Таким образом, GDI отчасти играет в рабочем цикле Rab-белков ту же роль, что и REP – в первом цикле.
Так описывали «механизм» действия Rab-белков в течение по крайней мере десятка лет. Это описание полностью соответствует действительности, при этом, однако, не дает абсолютно никакого представления о механизме регуляции слияния мембран Rab-белками. Спорить с тем, что Rab-белок играет ключевую роль в слиянии, не приходилось: к тому времени уже были получены триады точечных мутаций многих Rab-белков, способных связывать только ГТФ, только ГДФ и не связывать никакого нуклеотида. Первая форма была постоянно активна, а две вторые – постоянно неактивны. Соответственно, в первом случае на участке транспортного пути, за который отвечал данный Rab-белок, постоянно шли слияния и возникали увеличенные акцепторные компартменты, тогда как во втором наблюдалась везикуляция и уменьшенные транспортные пузырьки, либо они вообще отсутствовали. Эта проблема довольно долго вызывала несколько подозрительное отношение ученой общественности к Rab-белкам.
Положение стало меняться, когда накопилось достаточно данных о партнерах активных Rab-белков. Их оказалось очень много. Например, оказалось, что Rab5, основная малая ГТФаза ранних эндосом, может в активированном состоянии взаимодействовать с 25 белками. Интересно, что никаких общих доменов или последовательностей в них обнаружено не было.
Среди таких партнеров были SNARE, ферменты липидного обмена, моторные цитоскелетные белки, а также белки с неизвестной функцией.
С точки зрения регуляции слияний особый интерес привлекла большая группа белков и белковых комплексов, полностью лишенных какой-либо гомологии, но объединенных одним свойством: они могли взаимодействовать только с активным Rab- белком, при этом белки имели длинные линейные участки, либо, в случае мультимерных комплексов, их субъединицы образовывали «цепочки», которые, по-крайней мере, в одном измерении достигали 25–100 нм.
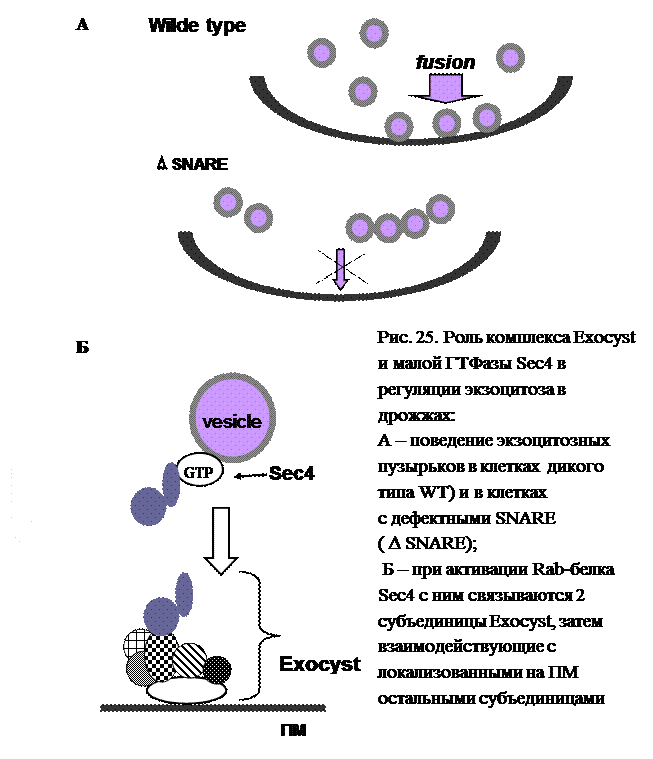
В ходе эксперимента на штамме дрожжей, экспрессирующих неспособные к взаимодействию v- и t-SNARE (рис. 25), работающие при слиянии экзоцитозных пузырьков с плазматической мембраной, оказалось, что пузырьки при этом не разбегаются свободно по всей клетке, а выстраиваются рядами на расстоянии около 100 нм от мембраны в зонах экзоцитоза. Эти зоны характеризуются наличием комплекса, называемого Exocyst.
Далее оказалось, что работающий на экзоцитозном пути Rab-подобный белок, Sec4, в активном состоянии присоединяет к себе несколько белков, которые при добавлении комплекса, сидящего на мембране, и формируют Exocyst. Впоследствии и для других Rab-белков были идентифицированы такие белки или белковые комплексы, получившие название “tethers” (англ. “привязь, коновязь, корд”). Поскольку русскоязычная калька этого термина не очень благозвучна, мы будем обозначать эти комплексы или белки как факторы дистанционного взаимодействия. Они играют фактически ключевую роль в первичном узнавании и заякоривании мембран, т. е. обеспечивают первый уровень специфичности взаимодействия, стабилизируя мембраны для дальнейшего сближения.
Как показывают наблюдения на живых клетках, стадия первоначального заякоривания достаточно длительна (порядка десятков секунд), за таким контактом может следовать как слияние, так и отсоединение везикулы с дальнейшими повторениями попытки соединения либо уходом от мембраны-мишени.
4.3. ВЗАИМОДЕЙСТВИЕ RAB-БЕЛКОВ
И SNARE В ХОДЕ СЛИЯНИЯ МЕМБРАН.
3 ФАЗЫСЛИЯНИЯ
Идентификация факторов дистанционного сближения для многих Rab-белков и анализ их взаимодействий позволил создать, а затем и подтвердить гипотезу, в которой нашлось место и SNARE, и Rab-белкам. Выяснилось, что Rab-белки, помимо (1) взаимодействия с факторами дистанционного взаимодействия и обеспечения заякоривания на мебране-мишени, как правило, могут узнавать t-SNARE (2), и (3) участвуют в снятии протекторного белка nSec1p, тем самым осуществляя «прайминг» SNARE- комплекса ― его реорганизацию в наиболее стабильную «шпильку».
Формирование последней позволяет стабилизировать мембраны везикулы и мишени на расстоянии менее 10 нм, что способствует уже перераспределению липидов в бислоях, заканчивающимся слиянием.
Таким образом, слияние происходит в 3 стадии (рис. 26):
1. Rab-белки связываются с факторами дистанционного сближения (tethers), обеспечивая специфическое заякоривание мембран везикулы и компартмента-акцептора на расстоянии до 25 нм (tethering), и снимают защиту с t-SNARE.
2. v- и t-SNARE образуют транс-комплекс и удерживают сливающиеся мембраны на расстоянии менее 10 нм, что способствует слиянию.
3. результатом формирования транс-комплекса является формирование поры слияния и дальнейшая реорганизация липидных бислоев, т.е. собственно слияние.
Таким образом, из трех стадий слияния 2 являются подготовительными, обеспечивающие высокую степень специфичности.
Все эти события происходят только тогда, когда Rab активирован. Очевидно, что контроль специфичности слияния весьма высок: он обеспечивается и Rab-белками, и SNARE-системой. Прямые молекулярные взаимодействия между компонентами обеих систем вносят дополнительный элемент в координацию процессов слияния, а значит, и транспортных путей.
 | |||||||
 | |||||||
 | |||||||
|
Рис. 26. Фазы слияния: 1) – заякоривание мембран
с помощью факторов Rab-зависимых дистанционного
взаимодействия и снятие протекторного белка;
2) – сближение мебран посредством формирования
транс-комплекса SNARE; 3) – непосредственно слияние,
т. е. реорганизация липидных слоев
4.4. ПОЛНОЕ СЛИЯНИЕ И ПОЛУСЛИЯНИЕ (SEMIFUSION). МЕХАНИЗМ «KISS-AND-RUN». РЕОРГАНИЗАЦИЯ ЛИПИДНЫХ БИСЛОЕВ
В ПРОЦЕССЕ СЛИЯНИЯ
Строго говоря, все, о чем говорилось выше, является подготовкой к слиянию, а не самим слиянием. Для полного слияния необходима реорганизация липидных бислоев обеих мембран, и этот процесс также идет в несколько стадий (рис. 27).
Сначала, после сближения мембран везикулы и мишени (рис. 27, б), начинают взаимодействовать липиды внешних слоев, и в результате с высокой степенью вероятности они перестраиваются так, что образуют одну общую внешнюю (т. е. ориентрованную в цитозоль) мембрану, при этом внутренние еще разделены (рис. 27, в). Состояние, при котором только один из слоев бислоя уже реорганизован, обозначается термином «hemifusion» (полуслияние). Как показали исследования, эти состояния (рис. 27, в, г) нестабильные, и в течение некоторого времени могут возникать и исчезать (это явление называется фликеринг, или мерцание). Если внутренние слои двух разных мембран вслед за этим также реорганизуются в одну общую внутреннюю мембрану, то в результате образуется так называемая «пора слияния», которую можно зарегистрировать электрофизиологическими методами (рис. 27, д). Это состояние тоже может демонстрировать фликеринг, но если пора стабилизируется, то процесс заканчивается полным слиянием (full fusion), показанным на рис. 27, е.
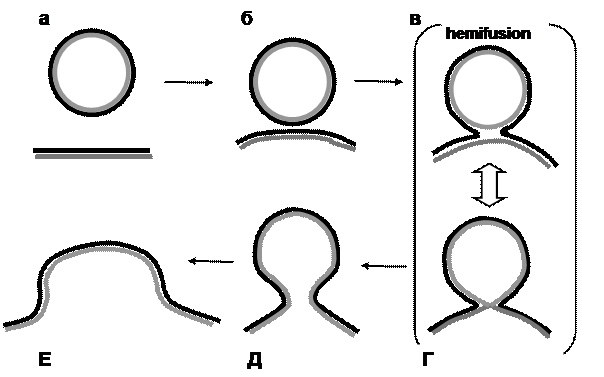
Рис. 27. Схема реорганизации липидных слоев двойной
мембраны в процессе слияния. Пояснения см. в тексте.
Для упрощения схемы SNARE-комплексы, обеспечивающие
стабилизацию мембран по отношению друг к другу,
не показаны
Однако прижизненная микросъемка флоресцентно меченых везикул показывает, что случаи, когда слияние происходит лишь ненадолго, и в результате две везикулы отсоединяются друг от друга, тоже имеют место. Такое кратковременное слияние также называют полуслиянием, или неполным слиянием, но в англоязычной литературе его обозначают термином «semifusion», в отличие от «hemifusion», которым обозначают чаще слияние одного из двух липидных слоев мембраны.
Итак, как упоминалось выше, стабилизированные друг напротив друга две мембраны перед полным слиянием проходят фазу неустойчивого взаимодействия, когда они, после кратковременного формирования поры слияния, вновь замыкают свои мембраны и разъединяются. Полуслияние, по всей видимости, не всегда является всего лишь неудавшимся слиянием. В определенных случаях полуслияние может являться самостоятельным механизмом со специфической регуляцией, получившим название «kiss-and-run». Так, очень часто секреторные гранулы образуют лишь кратковременный контакт с плазматической мембраной, после чего отделяются и уходят обратно в цитоплазму. Наиболее яркий пример – взаимодействие синаптических пузырьков (СП) с пресинаптической мембраной. СП способен сливаться с ней полностью, и в результате этого в синаптическую щель выбрасывается строго определенное количество нейромедиатора. С другой стороны, некоторые СП создают поры слияния с мембраной лишь на короткое время, и затем отсоединяются. Очевидно, что в этом случае количество выбрасываемого содержимого пропорционально времени, в течение которого пора слияния была открыта. Таким образом, механизм «kiss-and-run» позволяет избежать высвобождения нейромедиатора только строго определенными порциями.
Еще один пример – это образование «гибридной» везикулы при слиянии поздней эндосомы с лизосомой. Такая эндолизосома может существовать достаточно долго (минуты и десятки минут), но ее существование заканчивается сегрегацией мембран лизосомы и теперь уже бывшей поздней эндосомы, содержащей продукты деградации макромолекул. Морфологически такая «вторичная» поздняя лизосома может сохранять внутренние пузырьки или содержать вложенные друг в друга мембранные кольца, но плотность ее, как плавучая, так и электронная, увеличивается. Поэтому очень часто именно такие образования называют лизосомами.
Очевидно, что регуляция таких полуслияний может быть различна в каждом случае. Так, в случае экзоцитоза, и в частности, экзоцитоза синаптических пузырьков, существенную роль играет длительность и величина изменений концентрации ионов Са2+ в области слияния. Каким образом регулируется время жизни эндолизосомы, пока неизвестно.
Возможно, что существуют механизмы, позволяющие проводить слияние с больш е й вероятностью, хотя такие данные пока известны только для мембран, в которых локализуется протонная помпа V1/V0 (ее еще называют «везикулярной», поскольку в основном она работает на эндоцитозном пути, закачивая протоны внутрь эндосом). Эта помпа состоит из двух гексамерных комплексов, V1 (собственно АТФаза) и регуляторного Vо. Vo-комплекс пронизывает оба слоя мембраны, и может быть разобщен с каталитической частью, ведя «самостоятельное существование». Если два таких Vo-субкомплекса, находясь на разных мембранах, организуют «стопку», то латеральные пространства между мономерами оказываются удачными интерфейсами для перетекания и смешения липидов соседних мембран. Существует ли подобные механизмы поддержки слияния в других случаях, неизвестно.
4.5. RAB- И SNARE- НЕЗАВИСИМЫЕ
МЕХАНИЗМЫСЛИЯНИЯ
Следует отметить, что не все слияния в клетке опосредуются NSF-SNAP-SNARE-системой, хотя механизмы таких взаимодействий известны плохо: так, пероксисомы и митохондрии не имеют ни SNARE, ни Rab-белков, но, тем не менее, способны к гомотипическому слиянию. Хотя митохондрии не участвуют в процессах везикуляного транспорта, их внешняя мембран также может кратковременно сливаться с мембранами ЭПР, получая вновь синтезированные белки и липиды.
Целый ряд данных позволяет предполагать участие в процессах слияния везикул белков аннексинов. Они способны связывать Са2+ и взаимодействовать с фосфолипидами мембран, будучи сами фосфорилированными. В настоящее время вопрос об их месте в регуляции слияний мембран окончательно не решен, но предполагают, что они могут опосредовать весьма специфический процесс реорганизации мембраны везикулы в тех случаях, когда искривление мембраны идет в направлении «in-out», например, при формировании внутренних пузырьков мультивезикулярных эндосом.
Многие вирусы имеют свою машинерию для образования пор слияния, которая также основана на способности некоторых вирусных белков образовывать устойчивые мостики между мембранами оболочки вируса и клетки.