ТЕМА «Ферменты, строение свойства, классификация»
Ферменты (энзимы) – это вещества, которые присутствуют в тканях и клетках всех живых организмов и способны во много раз ускорять протекающие в них химические реакции.
Представления о белковой природе ферментов сложились в 30-х годах ХХ века, однако в 80-х годах были обнаружены ферменты рибонуклеотидной природы – рибозимы, тем не менее, большинство билогических катализаторов имеют белковую природу.
Ферменты – самый крупный и наиболее высокоспециализированный класс белковых молекул. Они могут быть простыми белками (например, гидролитические ферменты – протеазы, липазы, рибонуклеаза). Но в большинстве случаев ферменты – сложные белки (холоферменты). Холоферментысодержат наряду с белковой частью (апоферментом) небелковый компонент (кофермент или простетическую группу). Апофермент в отсутствие кофермента не обладает каталитической активностью. Кофермент с белковой молекулой (апоферментом) формируют молекулу холофермента, обладающую каталитической активностью.
Небелковый компонент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, флавинадениндинуклеотид (ФАД), флавинмононуклеотид (ФМН), биотин, липоевая кислота). Во втором случае кофермент взаимодействует с ферментом только на время химической реакции (например, никотинамидадениндинуклеотид (НАД+), никотинамидадениндинуклеотидфосфат (НАДФ+)). Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата.
В состав коферментов входит большинство водорастворимых витаминов:
| Витамины | Коферменты |
| РР (никотиновая кислота) | НАД+, НАДФ+ |
| В2(рибофлавин) | ФАД, ФМН |
| В6(пиридоксаль) | Пиридоксальфосфат |
| В1(тиамин) | Тиаминпирофосфат |
| В12 | Кобаламины |
Более 25 % всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Ионы металлов выполняют в ферментах разнообразные функции. Одни непосредственно участвуют в каталитическом акте, другие стабилизируют активный центр или поддерживают конформацию (пространственное расположение) молекулы фермента, а именно третичной и четвертичной структур; ионы двухвалентных металлов могут стабилизировать фермент-субстратный комплекс.
Целый рад ферментов состоит только из аминокислот, как обычные неферментные белки. Молекула многих ферментов состоит из одной полипептидной цепи. Это установлено для пепсина, трипсина, панкреатической α-амилазы и рибонуклеазы. Другие ферменты состоят из нескольких или же многих полипептидных цепей.
Существует два никотинамидных кофермента: Никотинамидадениндинуклеотид (НАД) и никотинамидадениндинуклеотидфосфат (НАДФ). Их строение следующее:
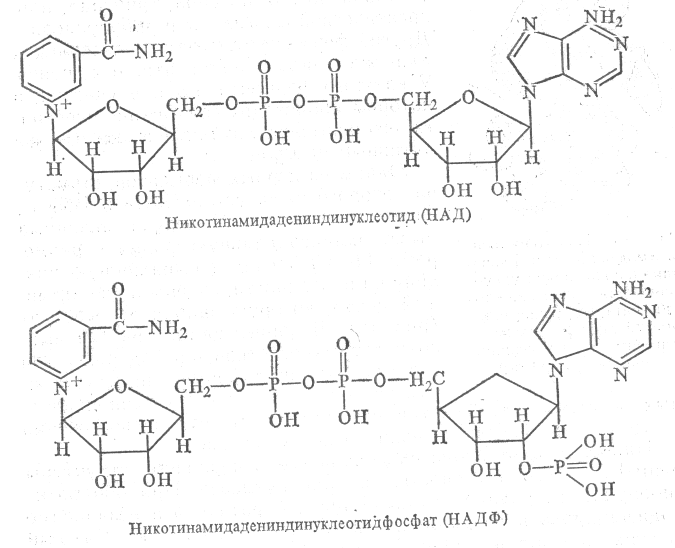
Для никотинамидных коферментов (НАД, НАДФ) функционально активной группой служит амид никотиновой кислоты (витамин РР), который в катализе окислительно-восстановительных реакциях претерпевает обратимые превращения.
Тиоловые коферменты. Широко распространенным тиоловым коферментом является кофермент ацетилирования (или ацилирования) кофермент А, важнейший из коферментов, принимающий участие в реакциях переноса ацильных
групп. КоА состоит из остатка адениловой кислоты (1), связанной пирофосфатной группой (2) с остатком пантотеновой кислоты (3), которая в свою очередь связанна пептидной связью с с остатком β-меркаптоэтаноламина (5):
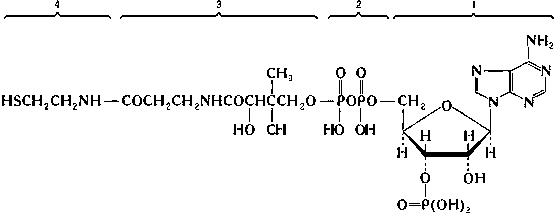 Он состоит из аденилового нуклеотида в виде фосфата, соединенного с пантотеновой кислотой, а последняя соединена с β-аминоэтантиолом:
Он состоит из аденилового нуклеотида в виде фосфата, соединенного с пантотеновой кислотой, а последняя соединена с β-аминоэтантиолом:
Свойства ферментов
В отличие от большинства катализаторов неорганической природы ферменты обладают более высокой эффективностью и специфичностью действия. В то время как небелковые катализаторы обычно ускоряют реакции в 10–103 раз, степень ускорения реакций под действием ферментов составляет 106–1012.
Один и тот же неорганический катализатор может быть использован для ускорения многих реакций, в которых участвуют самые разнообразные вещества. Что же касается ферментов, то они воздействуют либо только на один субстрат (абсолютная субстратная специфичность), либо на определенный класс субстратов (относительная субстратная специфичность). Например, уреаза катализирует только гидролиз мочевины, а пепсин – только гидролиз белков. Субстратная специфичность объясняется пространственным соответствием активного центра фермента и его субстрата.
Ферменты термолабильны – нагревание до температуры 70 – 80 С приводит к инактивации большинства ферментов за счет денатурации – разрушения вторичной и третичной структуры белка, т. е. потери пространственной конфигурации молекулы фермента, в том числе его активного центра.
Наиболее целесообразными температурами для физиологических характеристик активности ферментов следует считать близкие к температурам тела соответствующих животных, хотя комитет по ферментам Международного биохимического союза рекомендует там, где это возможно, придерживаться температуры 30 °С.
Ферменты чувствительны также к изменению рН среды, при которой они действуют. Это связано с изменением пространственной конфигурации молекулы фермента при присоединении или отщеплении протонов. Для каждого из ферментов существуют определенные оптимальные значения температуры и рН среды, при которых они проявляют свою максимальную активность. Например, пепсин наиболее активен при рН 1,5–2,0 (кислая среда), а трипсин – при 7,8–8,0 (слабощелочная среда). Если рН среды значительно отличается от оптимума, то фермент полностью или частично теряет свою активность.
Температура и рН относятся к неспецифическим факторам, так как в той или иной мере влияют на активность всех ферментов.
Кроме того, существуют специфические факторы, которые в очень низких концентрациях повышают активность ферментов (активаторы) или, напротив, снижают ее (ингибиторы).
Регуляция активности ферментов в организме происходит через аллостерический центр (allos – чужой), который обычно удален от активного центра. Этот процесс происходит чаще всего по принципу обратной отрицательной связи, когда продукт реакции аллостерически подавляет активность фермента.
Снижение активности фермента наблюдается и при конкуренции ингибитора с субстратом за активный центр фермента в случае их структурного сходства (конкурентное ингибирование). Это варианты обратимого ингибирования, при котором после удаления ингибитора активность фермента восстанавливается. Однако возможно и необратимое ингибирование вследствие химической модификации активного центра.
На основании многочисленных наблюдений и экспериментов выявлено, что весьма важными условиями для обеспечения активности ферментов в организме животных является обеспеченность их кофакторами, необходимыми для проявления действия того или иного фермента. Это относится к витаминам, являющимся коферментами многих ферментов. На основании этого было разработано применение витаминов в лечебной практике с целью регулирования действия соответствующих ферментов