Реакции, идущие без изменения состава веществ
1) В неорганической химии к таким реакциям относятся реакции аллотропизации – это реакции, например:
С (графит) ↔ С (алмаз)
S (ромбическая) ↔ S (моноклинная)
Р (белый) ↔ Р (красный)
Sn (белое олово) ↔ Sn (серое олово)
3O2 (кислород) ↔ 2O3 (озон)
2) В органической химии к этому типу реакций относятся реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например: изомеризация алканов.
Реакции, идущие с изменением состава вещества
1) По числу и составу исходных веществ и продуктов реакции:
а) Реакции соединения – это такие реакции, при которых из двух и более веществ образуется одно сложное вещество
S + O2 = SO2
SO2 + О2 = 2SO3
SO3 + Н2O = Н2SO4
В органической химии реакции соединения принято называть «реакциями присоединения». Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1. Реакция гидрирования – присоединения водорода:
CH2 = CH2 + Н2 → СН3 – СН3
2. Реакция гидратации – присоединения воды.
CH2 = CH2 + Н2О → СН3 – СН2ОН
3. Реакция полимеризации.
nCH2 = CH2 → (–СН2 – СН2–)n
б) Реакции разложения – это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
2KMnO4 = K2MnO4 + MnO2 + O2
2CH4 → C2H2 + 3H2
в) Реакции замещения – это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе.
2Na + 2Н2O = 2NаОН + Н2
СН4 + Br2 = CH3Br + HBr
Особенность реакции замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещество, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола. Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
г) Реакции обмена – это такие реакции, при которых два сложных вещества обмениваются своими составными частями
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, то есть только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, Н2O).
СuSO4 + 2КОН = Сu(ОН)2 + К2SO4
СН3СООН + NаОН = СН3СООNа + Н2O
2НCl + СаСO3 → СаCl2 + СO2↑ + Н2O
2) По изменению степеней окисления химических элементов:
По этому признаку различают следующие реакции:
а) Окислительно-восстановительные реакции – реакции, идущие с изменением степеней окисления элементов.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
Mg0 + H2+1SO4 = Mg+2SO4 + H20
2Mg0 + O20 = Mg+2O-2
2H2+1O2-1 = 2H2O-2 + O20
б) Неокислительно-восстановительные – реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также многие реакции соединения и разложения, если участвуют только сложные вещества.
СаСО3 = СО2 + H2O
К2О + Н2О = 2КОН
По тепловому эффекту
а) Экзотермические реакции – реакции, которые протекают с выделением теплоты.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота(II) из азота и кислорода и реакция газообразного водорода с твердым иодом.
Н2 + С12 = 2НС1 + 92,3 кДж
б) Эндотермические реакции – реакции, которые протекают с поглощением теплоты.
К ним будут относиться почти все реакции разложения.
N2 + O2 ↔ 2NO – 90,4 кДж
4) По агрегатному состоянию веществ:
а) Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах).
S(т) + О2(г) = SO2(г)
б) Гомогенные реакции – реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе).
Н2(г) + С12(г) = 2НС1(г)
5) По участию катализатора:
а) Некаталитические реакции – реакции, идущие без участия катализатора.
б) Каталитические реакции – реакции, идущие с участием катализатора. Так как все биохимические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы – ферментов, все они относятся к каталитическим или, точнее, ферментативным.
6) По направлению:
а) Необратимые реакции – реакции, которые протекают в данных условиях только в одном направлении. К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды) и все реакции горения.
б) Обратимые реакции – реакции, которые в данных условиях протекают одновременно в двух противоположных направлениях. Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия - антонимы процессов:
- гидрирование – дегидрирование,
- гидратация – дегидратация,
- полимеризация – деполимеризация.
По механизму протекания
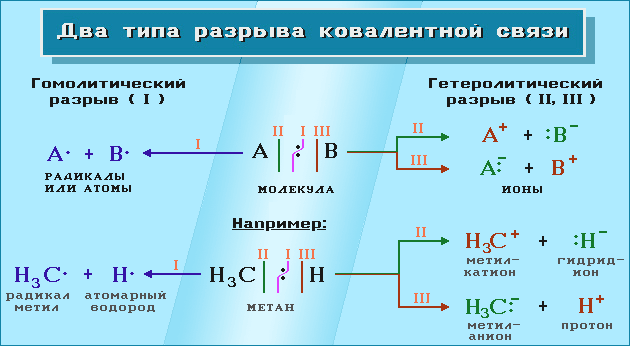
а) Радикальные реакции – реакции, идущие между образующимися в ходе реакции радикалами и молекулами.
При всех реакциях происходит разрыв старых и образование новых химических связей. Способ разрыва связи в молекулах исходного вещества определяет механизм (путь) реакции. Если вещество образовано за счет ковалентной связи, то могут быть два способа разрыва этой связи: гемолитический и гетеролитический. Например, для молекул Сl2, СН4 и т. д. реализуется гемолитический разрыв связей, он приведет к образованию частиц с неспаренными электронами, то есть свободных радикалов.
По радикальному механизму протекают большинство реакций горения органических и неорганических веществ, синтез воды, аммиака, полимеризация этилена, винилхлорида и др.
б) Ионные реакции – реакции, идущие между имеющимися или образующимися в ходе реакции ионами.
Типичные ионные реакции – это взаимодействие между электролитами в растворе. Ионы образуются не только при диссоциации электролитов в растворах, но и под действием электрических разрядов, нагревания или излучений. γ-Лучи, например, превращают молекулы воды и метана в молекулярные ионы.
По другому ионному механизму происходят реакции присоединения к алкенам галогеноводородов, водорода, галогенов, окисление и дегидратация спиртов, замещение спиртового гидроксила на галоген; реакции, характеризующие свойства альдегидов и кислот. Ионы в этом случае образуются при гетеролитическом разрыве ковалентных полярных связей.
По виду энергии, инициирующей реакцию
а) Фотохимические реакции. Например: синтеза НСl или реакции метана с хлором, получение озона в тропосфере. К этому виду реакций принадлежит и важнейший процесс, протекающий в растительных клетках, – фотосинтез.
б) Радиационные реакции. Они инициируются излучениями большой энергии - рентгеновскими лучами, ядерными излучениями (γ-лучами, a-частицами и др.). С помощью радиационных реакций проводят очень быструю радиополимеризацию, радиолиз (радиационное разложение) и т. д.
Вулканизация каучука может быть проведена без серы с использованием радиовулканизации, и полученная резина будет ничуть не хуже традиционной.
в) Электрохимические реакции. Их инициирует электрический ток.
г) Термохимические реакции. Их инициирует тепловая энергия. К ним относятся все эндотермические реакции и множество экзотермических реакций, для начала которых необходима первоначальная подача теплоты, то есть инициирование процесса.
Классификация химических реакций, как и все другие классификации, условна. Ученые договорились разделить реакции на определенные типы по выделенным ими признакам. Конкретная химическая реакция всегда многокачественна, ее характеризуют разные признаки. Например, процесса синтеза аммиака:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9кДж
Это реакция соединения, окислительно-восстановительная, экзотермическая, обратимая, каталитическая, гомогенная. Для успешного управления процессом необходимо учитывать все приведенные сведения.
Рассмотренная выше классификация химических реакций отражена на схеме: