Кислотно – основное титрование.
Метод кислотно-основного титрования основан на реакциях взаимодействия между кислотами и основаниями, то есть на реакции нейтрализации:
Н + + ОН ˉ ↔ Н2О
Рабочими растворами метода являются растворы сильных кислот (HCl, H2S, НNОз и др.) или сильных оснований (NaOH, КОН, Ва(ОН)2 и др.).
В зависимости от титранта метод кислотно-основного титрования подразделяют на ацидиметрию, если титрантом является раствор кислоты, и алкалиметрию, если титрантом является раствор основания.
Рабочие растворы в основном готовят как вторичные стандартные растворы, поскольку исходные для их приготовления вещества не являются стандaртными, а затем их стандартизуют по стандартным веществам или стандартным растворам.
Например: растворы кислот можно стандартизовать по стандартным веществам - натрия тетраборату Na2B4О7 ∙10Н2О, натрия карбонату Nа2СО3 ∙10Н2О или по стандартным растворам NaOH, КОН; а растворы оснований - по щавелевой кислоте Н2С2О4 ∙ 2Н2О, янтарной кислоте Н2С4Н4О4 или по стандартным растворам HCl, H2SO4, НNО3.
ИНДИКАТОРЫВ МЕТОДЕ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
В методах кислотно-основного титрования для определения конечной точки титрования используют кислотно-основные индикаторы.
Кислотно-основные индикаторы - это органические вещества, способные видимо и обратимо изменять свою окраску в растворе при изменении рН среды.
Существуют различные теории индикаторов, каждая из которых по-своему объясняет поведение кислотно-основных индикаторов в кислых и щелочных средах.
Ионная теория индикаторов. В связи с тем, что кислотно-основные индикаторы представляют собой слабые кислоты или слабые основания, любой индикатор диссоциирует в растворе согласно уравнению:
HInd ↔ Н+ + Ind- бесцветный малиновый
Окраска раствора, в котором индикатор находится в молекулярной форме (HInd), отличается от окраски раствора, в котором индикатор находится в ионной форме (Ind ˉ). Так, молекулы фенолфталеина HInd бесцветны, а его анионы Ind ˉ окрашены в малиновый цвет. Достаточно к раствору, содержащему фенолфталеин, прибавить 1-2 капли щелочи, как введенные ОНˉ-ионы станут связывать катионы Н+ с образованием слабого электролита - молекул воды. При этом равновесие диссоциации индикатора сместится вправо, и накопление анионов Indˉ вызовет окрашивание раствора в малиновый цвет.
Типичным одноцветным индикатором является фенолфталеин.
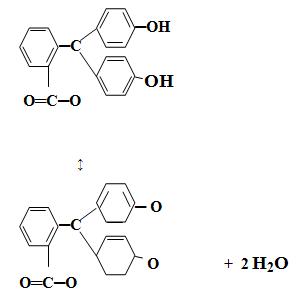
Типичным двухцветным индикатором является метиловый оранжевый:
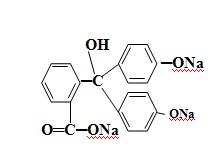
При рН = 3,2...4,3 он оранжевый, при рН ≤ 3,1 приобретает красную, а при рН ≥ 4,4 - желтую окраску.
Окислительно – восстановительное титрование.
Методы окислительно-восстановительного титрования основаны на использовании реакций, связанных с переносом электронов, то есть окислительно-восстановительных процессов.
Методы окислительно-восстановительного титрования пригодны для определения многих органических соединений, в том числе фармацевтических препаратов, подавляющее большинство которых являются потенциальными восстановителями.
В зависимости от свойств используемоготитранта различают оксидиметрию и редуктометрию.
Оксидиметрия - метод определения восстановителей путем титрования их стандартными растворами окислителей. Например, в перманганатометриив качестве титранта используют раствор перманганатакалия, в броматометрии - раствор броматакалия, в хроматометрии - раствор хромата (дихромата) калия.
Редуктометрия - метод определения окислителей путем титрования их стандартными растворами восстановителей. Например, в аскорбинометрии - раствор аскорбиновой кислоты, в феррометрии - растворы солей железа (ІІ).
Направление реакций окисления-восстановления зависит от соотношения энергии сродства высших степеней окисления реагирующих частиц к электронам.
ПЕРМАНГАНАТОМЕТРИЯ
Перманганатометрия - метод, основанный на использовании калия перманганата в качестве титранта для определения соединений, которые обладают восстановительными своиствами.
Продукты восстановления перманганат-ионов могут быть различными в зависимости от рН среды:
· в кислой среде
Мn+7 + 5 е → Мn+2
· нейтральной среде
Мn+7 + 3 е → Мn+4
· слабощелочной среде
Мn+7 + 1 е → Мn+6
Для анализа чаще всего используют окислительные свойства МnО4 ‾ - ионов в сильнокислой среде, так как продуктом их восстановления в этом случае являются бесцветные ионы Мn2+ ( в отличие от бурого осадка МnО2), которые не мешают наблюдать изменение окраски титруемого раствора от избыточной капли титранта. Необходимое значение рН среды создают с помощью раствора серной кислоты.
Титрант метода - раствор 0,1 (0,05) моль/дм3 перманганата калия - готовят как вторичный стандартный раствор и стандартизуют по стандартным веществам: щавелевой кислоте, оксалатунатрия и др.
Титрованный раствор перманганатакалия по точной навеске кристаллического препарата приготовить невозможно, так как в нем всегда содержатся некоторое количество МnО2 и другие продукты разложения.
Перед установлением точной концентрации раствор КМnО4 выдерживают в темной склянке в течение 7-10 дней. За это время происходит окисление восстановителей, присутствие которых в дистиллированной воде полностью исключить не удается (пыль, следы органических соединений и т. п.). Для ускорения этих процессов раствор перманганата калияиногда кипятят.
В перманганатометрии часто обходятся без применения специального индикатора, так как сам перманганат имеет интенсивную окраску, а его избыточная капля вызывает появление неисчезающей в течение 30 с розовой окраски pacтвора.
Перманганатометрическим методом можно определить:
· восстановители Н2О2, NО2, C2О42-, Fe2+ и пр.,
· Са2+, Ва2+ и другие катионы в различных препаратах;
· МnО2, РbО2, K2Cr2O7, персульфаты и другие окислители обратным титрованием;
· можно определить муравьиную, винную, лимонную, салициловую и другие кислоты, глицерин, фенол, формальдегид и другие органические соединения.
ХРОМАТОМЕТРИЯ (ДИХРОМАТОМЕТРИЯ)
Дихроматометрия - метод определения, основанный на окислении веществ дихромат-ионами.
Сr+6 + 3 е → Сг3+
В кислой среде К2Сr2О7 является сильным окислителем, следовательно, этим методом возможно определение целого ряда неорганических и органических восстановителей, например Fe2+, [Fe(CN)6]4-, SO32-, метанола, аскорбиновой кислоты и др.
Кислую среду при титровании обычно создают с помощью растворов серной или ортофосфорной кислот.
Титрантом метода является раствор 0,1 моль/дм3 К2Сr2О7.
Поскольку К2Сr2О7 является стандартным веществом, из него готовят титрант первичной стандартизации.
Растворы калия дихромата следует хранить в закрытой посуде в темном месте. В этих условиях титр раствора остается стабильным в течение продолжительного времени.