Цель: построение кривых титрования и контроль потенциала ионоселективного электрода и оптической плотности
Посуда и реактивы: компьютер, датчик оптической плотности 525нм,цифровой датчик-переходник для подсоединения электродов, медь-селективный электрод, электрод сравнения, датчик объёма жидкого реагента, шприц на 10 мл., кюветы,градуированные пипетки на 2 и 10 мл., магнитная мешалка, штатив химический, штатив для электродов, химический стакан. Раствор ЭДТА 0,05М. Проба сульфата меди 0,02М, ацетатный буферный раствор1+1М. Индикатор – мурексид сухой. Буферный раствор СН3СООН 1М+СН3СООNа 1М.
Задание: выполните опыты, оформите отчёт.
Правила техники безопасности:
1. Правила работы с реактивами.
2. Правила работы с химической посудой.
3. Правила работы с нагревательными приборами.
4. Правила работы с измерительными приборами.
Методические указания к выполнению лабораторной работы:
Потенциометрическое титрование основано на определении точки эквивалентности по результатам потенциометрических измерений. Вблизи точки эквивалентности происходит резкое изменение (скачок) потенциала индикаторного электрода. Это наблюдается, конечно, лишь тогда, когда хотя бы один из участников реакции титрования является участником электродного процесса. Так, например, титрование по методу кислотно-основного взаимодействия может быть выполнено со стеклянным электродом.Потенциометрическое титрование катионов комплексоном III (ЭДТА) можно проводить с использованием в качестве индикаторного электрода соответствующего металла: титрование солей меди с медным электродом.
Более простым и точным способом нахождения ТЭ является графическое изображение зависимости величин первой производной ΔE/ΔV от объема, прибавленного титранта V (дифференциальная кривая). В этом случае кривая имеет пикообразную форму, максимум которой соответствует ТЭ
|
|
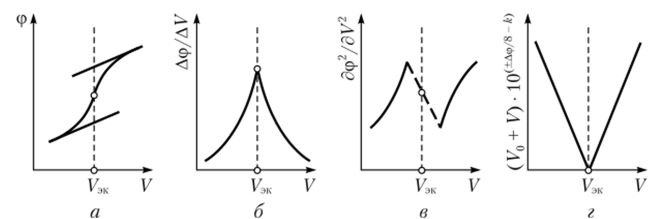
Кривые потенциометрического титрования: а – интегральная; б – дифференциальная.