№1 Как приготовить 200 мл 0,2М раствора гидроксида калия?
№2 Как приготовить 200 г 3% раствора соды?
№3 Как приготовить 1% раствор марганцовки из 500 г 5% раствора?
V Выполните упражнения.
№1 Выпишите из списка веществ электролиты. Напишите уравнения диссоциации для каждого из них. На какие три группы по составу можно разделить эти вещества? Назовите эти электролиты.
Al2(SO4)3, C2H5OH, HCl, MgCl2, H2SO4, C6H12O6 , NaOH, Na3PO4, Ba(OH)2.
№2. Пользуясь таблицей растворимости запишите уравнение диссоциации для: а) хлорида кальция, б) сульфат натрия, в) гидроксид калия, г) фосфорная кислота, д) нитрат магния. Для кого из них можно записать несколько уравнений процесса диссоциации? Почему?
№3 Напишите формулы веществ, которые при диссоциации дают ионы: а) Ba2+и OH-, б) Ca2+и NO3-, в) H+ и NO3-. Назовите эти вещества.
№4. Пользуясь алгоритмом напишите молекулярное, полное ионное и сокращенное уравнение. Выполните вариант 1, сверьте результаты с ответами. Если все верно, или допущены 1-2 незначительные ошибки, переходите ко 2 варианту. Если нет – еще раз решите 1 вариант. После выполнения 2 варианта проверьте работу. Если все правильно, переходите к следующему номеру, если нет – еще раз попробуйте самостоятельно написать ионные уравнения из 2 варианта
Алгоритм составления ионных уравнений:
1) Составьте формулы электролитов, вступивших в реакцию ионного обмена и формулы продуктов реакции.
2) Расставьте коэффициенты в уравнении.
3) Отметьте вещества, которые не распадаются на ионы (т.е. малорастворимые вещества, газы, слабые электролиты: вода или некоторые кислоты). Пользуйтесь таблицей растворимости.
4) Перепишите уравнения, записывая вместо формулы сильного электролита ионы, на которые он распадается, с учетом числа этих ионов в молекуле (индекса) и числа молекул этого вещества (коэффициента в уравнении).
5) Зачеркните справа и слева в уравнении ионы, которые повторяются.
6) Перепишите то, что осталось отдельной строкой.
Вариант 1.
а) Ca(NO3)2 + K2CO3 => CaCO3â + KNO3
б) HNO3 + Ba(OH)2 => Ba(NO3)2 + H2O
в) NaOH + CuSO4 => Cu(OH)2â + Na2SO4
Вариант ІІ.
а) FeCl3 + NaOH =>
б) AgNO3 + MgCl2 =>
в) H3PO4 + NaOH =>
г) NaCl + AgNO3 = >
д) K2CO3 + HNO3 =>
е) Cu(OH)2 + HCl =>
Ответы к 1 варианту.
а) Сa(NO3)2 + K2CO3 =>CaCO3â + 2KNO3
Ca2+ + 2NO3- + 2K+ + CO32- => CaCO3â +2K+ + 2NO32-
Ca2+ + CO32- => CaCO3â
б) 2HNO3 + Ba(OH)2 =>Ba(NO3)2 + 2H2O
2H+ + 2NO3- + Ba2+ +2OH- => Ba2+ + 2NO3- + 2H2O
H++ OH- => H2O
в) 2NaOH + CuSO4 => Cu(OH)2â + Na2SO4
2Na+ + 2OH- + Cu2+ + SO42- => Cu(OH)2â + Na2SO4
2OH- + Cu2+ => Cu(OH)2â
Ответы ко 2 варианту
а) FeCl3 + 3NaOH = Fe(OH)3â + 3NaCl
Fe3+ + 3Cl- + 3Na+ + 3OH- = Fe(OH)3â + 3Na++ 3Cl-
Fe3+ + 3OH- = Fe(OH)3â
б) 2AgNO3 + MgCl2 = 2AgClâ + Mg(NO)3
2Ag+ + 2NO3 + Mg2+ + 2Cl- = 2AgClâ +Mg2+ +2NO3-
Ag+ + Cl- = AgClâ
в) H3PO4 + 3NaOH = Na3PO4 + 3H2O
3H+ + PO43- + 3Na+ + 3OH- = 3Na+ + PO43- + 3H2O
H+ + OH- = H2O
г) NaCl + AgNO3 = AgClâ + NaNO3
Na+ + Cl- + Ag+ + NO3- = AgClâ + Na+ + NO3--
Ag+ + Cl- = AgClâ
д) K2CO3 + 2HNO3 = 2KNO3 + H2O + CO2á
2K+ + CO32- + 2H+ + 2NO3- = 2KNO3 + H2O + CO2á
2H+ + CO32- = H2O + CO2á
е)Cu(OH)2â + 2HCl = CuCl2 + 2H2O
Cu(OH)2â + 2H+ +2Cl- = Cu2+ + 2Cl- + 2H2O
Cu(OH)2â + 2H+ = Cu2+ + 2H2O
№5. Запишите молекулярные и ионные уравнения, которые могут протекать в растворах между веществами. Какие из этих процессов протекают необратимо? Почему?
А) сульфат железа (П) и гидроксид калия
Б) фосфорная кислота и гидроксид лития
В) сульфат натрия и хлорид железа (Ш)
Г) карбонат натрия и фосфорная кислота
Д) гидроксид алюминия и соляная кислота
Е) оксид меди (П) и азотная кислота
№6 Приведите примеры двух реакций, которые можно выразить сокращенным уравнением Запишите для них молекулярные и полные ионные уравнения:
А) Al3+ + 3OH- = Al(OH)3â
Б) H+ + OH- = H2O
№7 Какие ионы могут одновременно существовать в растворе, а какие нет? Почему?
а) Н+ и CO32- б) Cu2+ и SO42- в) Fe2+ и ОН-
№8 Можно ли назвать амфотерным ион НCO3- и почему? Ответ подтвердите уравнениями реакций.
№9. Раствор хлорида меди ядовит. С каким ионом, находящимся в растворе связана токсичность этой соли?
№10. Какая среда будет в растворах а) гидроксида лития, б) сероводорода, г) нитрата кальция, д) хлорида хрома (П), фторида натрия. Ответ поясните ионными уравнениями.
№11 Какие соли нельзя хранить в виде растворов? А) хлорид серебра, б) карбонат калия, в) нитрат натрия, г) сульфид аммония. Ответ поясните.
№ 12. Пользуясь формулами [H+]· [OH-] 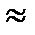 10-14моль/л и рН = -lg [H+], заполните свободные клетки
10-14моль/л и рН = -lg [H+], заполните свободные клетки
| [H+] | [OH-] | рН | рОН | кислотность среды |
| 10-3 | ||||
| 10-5 | ||||
| нейтральная |
№ 13 Вычислите чему равен рН раствора 0,001моль/л НСl?
№14 В растворе соды рН равно 9. Определите молярную концентрацию ионов водорода в этом растворе?
№15. В результате проведенного лечения рН желудочного сока у больного изменилась от 4 до 2. Можно ли считать этот результат успешным? Как изменилась при этом концентрация ионов водорода в желудочном соке?
VI * Напишите эссе на одну из тем: «Водно-солевой баланс в организме человека», «Буферные системы организма», «Кислотно-щелочное равновесие – основа гомеостаза», «Ацидоз и алкалоз», «рН-метрия в медицине».