ПРОМЫШЛЕННЫХ ТЕХНОЛОГИЙ И ДИЗАЙНА»
ВЫСШАЯ ШКОЛА ТЕХНОЛОГИИ И ЭНЕРГЕТИКИ
Кафедра технологии целлюлозы и композиционных материалов
Контрольная работа
по общей химической технологии
Вариант 4
Выполнил
Студент гр. 136
Ромашева Маргарита Максимовна
Проверил
Ассистент___________________________________ Уварова Д.Ю.
Санкт-Петербург
Введение
Будучи школьницей я хотела связать свою жизнь с химией и поэтому поступила в Высшую школу технологии и энергетики. Данное заведение предоставляет широкий спектр возможностей для саморазвития: здесь есть кружки для физического развития и студенческое научное общество для научных исследований студентов. Мне нравится учиться здесь. Я надеюсь, что стану хорошим специалистом в области полимерного производства и устроюсь на хорошую работу по специальности.
Для меня химическая технология неразрывна связана с использованием машин, реакторов и химических реакций. Химическую технологию используют для производства как для производства продуктов питания и мебели, так и покрытий, строительных материалов. Современный мир в том виде, что мы сегодня знаем, стал таким благодаря во многом химической технологии. На данном этапе технологического развития общества химическая технология позволяет наиболее полно удовлетворить потребности общества.
Мне нравиться учиться и узнавать новое. Я надеюсь стать хорошим специалистом.
Производство водорода из метана и воды. Физико-химические основы процесса
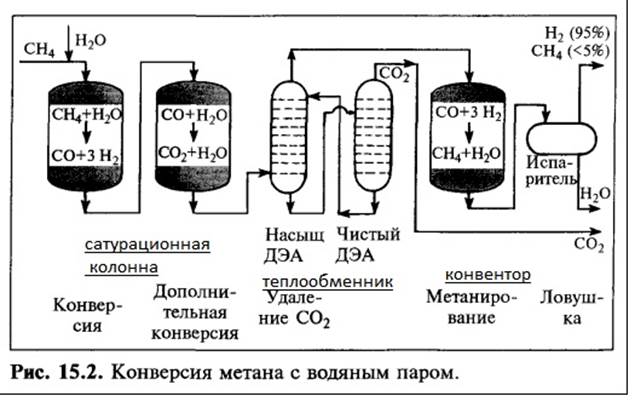
Более 50% всего водорода получается путём паровой конверсии воды и метана. При этом три основных составляющих (природный газ, водяной пар и оксиген) смешиваются в определённых пропорциях. [1]
|
|
При температурах 750–850 градусов Цельсия через стенку трубы на каталитических поверхностях (никель, корунд и др.):
CH4+H2O ↔ CO+3H2;
далее с м «угарным газом» идёт реакция:
CO+H2O ↔ CO2+H2.
В парокислородной конверсии вместе с горячим паром в активную зону реактора подаётся кислород. Реакции процесса аналогичные, что и для ПКМ, однако дополнительно происходит окисление метана кислородом:
CH4+O2 ↔ 2CO+3H2.
Реагирование веществ в парокислородной конверсии метана даёт общий результирующий тепловой эффект, равный нулю!
Главное преимущество парокислородной конверсии по сравнению с ПКМ — передача теплоты напрямую, а не через стенку теплообменника.[2]
Простота и относительная лёгкость делает производство водорода путём паровой конверсии наиболее дешёвым из всех доступных.[1]
Схема получения полиэтилена под высоким давлением
Выше приведена принципиальная схема получения полиэтилена ВД в трубчатом реакторе непрерывным способом.
Из цеха газоразделения свежий этилен под давлением 0,8 -- 1,1 МПа поступает в коллектор 1 и затем в смеситель 2, в котором смешивается с возвратным этиленом низкого давления (НД). Далее в поток вводят кислород, и смесь поступает в трехступенчатый компрессор первого каскада 3, где сжимается до 25 МПа. После каждой ступени этилен охлаждается в холодильниках, отделяется от смазки в сепараторах, а затем поступает в смеситель 4, в котором смешивается с возвратным этиленом ВД из отделителя 7. Затем смесь направляется в двухступенчатый компрессор 5 второго каскада, где сжимается до 245 МПа.
|
|
После первой ступени сжатия этилен охлаждается в холодильнике, очищается от смазки в сепараторах, а после второй ступени при температуре около 70 °С (без охлаждения по трем вводам) поступает в трубчатый реактор 6 на полимеризацию.
Реактор-полимеризатор состоит из трех зон, перед каждой зоной имеется теплообменник для подогрева газа или реакционной смеси в зависимости от применяемого инициатора до 120--190 °С. В конце третьей зоны имеется холодильник, в котором реакционная масса охлаждается до 200 -- 250 °C (теплообменники и холодильник на схеме не показаны).
Из трубчатого реактора 6 смесь непрореагировавшего мономера с полимером через редукционный вентиль под давлением 24,5 -- 26,3 МПа поступает в отделитель высокого давления, в котором за счет разности плотностей этилена и полиэтилена происходит их разделение. Непрореагировавший этилен из верхней части отделителя высокого давления 7 направляется в циклонные сепараторы 11 и холодильники 12, где от этилена отделяются унесенные частицы полиэтилена. Затем этилен охлаждается, поступает на смешение со свежим газом в смеситель 4 и возвращается в цикл.
Расплавленный полиэтилен из нижней части отделителя высокого давления 7 через дросселирующий вентиль направляется в отделитель низкого давления 8, в котором поддерживается давление 0,15 -- 0,59 МПа.
Расплав полиэтилена, освобожденный от остатков растворенного этилена при 180-- 190 °С, через загрузочный штуцер направляется в гранулирующие агрегаты 9.
Этилен из отделителей низкого давления 8 после очистки и охлаждения в циклонном сепараторе 14, холодильнике 15 и фильтре 16 поступает в компрессор предварительного сжатия (0,9-- 1,7 МПа) 17, затем в коллектор 7 свежего этилена и возвращается в цикл,
|
|
В гранулирующий агрегат 9 непрерывно подается стабилизирующая смесь (фенил-б-нафтиламин с дифенил-n-фенилендиамином) и другие добавки. Полиэтилен, смешанный со стабилизатором, направляется на грануляцию. Для быстрого охлаждения гранул в гранулирующую головку подается обессоленная вода.
Охлажденные до 60 -- 70 °С гранулы полиэтилена выносятся водой на вибросито 10, на которое после удаления основного количества влаги подается теплый воздух для окончательной сушки. Готовый полиэтилен упаковывают в мешки или направляют на конфекционирование.
Полиэтилен ВД выпускается в натуральном виде или окрашенным в различные цвета. [4]
Задача 4
Как повлияет на равновесие следующих реакций:
1)2Н2(Г)+О2(Г)↔ 2Н2О(Г), ΔНХР = – 433,6 кДж;
2)СаСО3(К) ↔ СаО(К)+СО2(Г), ΔНХР = 179,0 кДж
а) повышение температуры;
б) повышение давления?
Ответ пояснить.
Принцип Лешателье: Если на систему в равновесии воздействова из-вне, изменяя температуру, давление, концентрацию, то равновесие смещается таким образом, чтобы компенсировать это изменение. [3]
При повышении температуры равновесие смещается в сторону эндотермической реакции.
2Н2(Г)+О2(Г)↔ 2Н2О(Г), ΔНХР = – 433,6 кДж; - экзотермическая
В сторону начальных реагентов
СаСО3(К) ↔ СаО(К)+СО2(Г), ΔНХР = 179,0 кДж – эндотермическая
В сторону продуктов реакции
Для газовых реакций при повышении давлении равновесие смещается в сторону меншего объёма.
2Н2(Г)+О2(Г)↔ 2Н2О(Г), ΔНХР = – 433,6 кДж;
Посчитаем объём (2+1)*22,4< 2*22,4 => равновесие смещается в сторону продукта реакции.
СаСО3(К) ↔ СаО(К)+СО2(Г), ΔНХР = 179,0 кДж
Посчитаем объём 0*22,4< 1*22,4 => равновесие смещается в сторону исходных реагентов.
Список использованных источников:
1. Интернет ресурс: https://biznesprost.com/otkryt-biznes/proizvodstvo-vodoroda.html Дата обращения 28.11.2020
2. Интернет ресурс: https://zen.yandex.ru/media/dbk/vodorodnaia-energetika-metody-polucheniia-vodoroda-5e7b530441521e01e08bd7f9 Дата обращения 28.11.2020
3. Интернет ресурс: https://www.studmed.ru/muhlenov-i-p-i-dr-osnovy-himicheskoy-tehnologii_8f86fcde47a.html Дата обращения 28.11.2020
4. Интернет ресурс: https://studopedia.ru/2_70956_proizvodstvo-polietilena-visokogo-davleniya-v-trubchatom-reaktore.html Дата обращения 28.11.2020