ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение
Высшего образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Кафедра общей химии
Отчет по лабораторной работе № 1
По дисциплине ХИМИЯ
(наименование учебной дисциплины согласно учебному плану)
Тема: Определение эквивалентной массы металла
Автор: студент гр. ИЗБ-20-1 Виноградова К.И.
(группа) (подпись) (Ф.И.О.)
ОЦЕНКА:
Дата: 9 октября 2020 г.
| ПРОВЕРИЛ | Ассистент | Черняев В.А. | |||
| (должность) | (подпись) | (Ф.И.О.) |
Санкт-Петербург
2020 год
Цель работы: усвоить понятие о химическом эквиваленте и научиться определять эквивалентные массы веществ.
Общие сведения:
Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода в химических реакциях. Эквивалентной массой Эм называется масса одного эквивалента вещества, т.е. масса вещества и количество эеквивалентов связаны уравнением:
Ŋэкв = 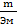 .
.
Эквивалентную массу вещества, вступающего в химическую реакцию (образующегося в ходе реакции), можно вычислить, пользуясь законом эквивалентов: вещества взаимодействуют друг с другом в эквивалентных количествах, т.е. числа эквивалентов взаимодействующих веществ равны друг другу.
Отсюда следует другая формулировка закона эквивалентов: массы взаимодействующих веществ пропорциональны их эквивалентным массам.
На основе закона эквивалентов можно вывести общую формулу для вычисления эквивалентных масс веществ:
Эм=  ,
,
где М – молярная масса вещества, г/моль; z – число эквивалентов в 1 моле вещества. Величина z для кислот равна основности кислоты, для оснований – числу ОН-групп в основании, для солей – произведению количества катионов в формуле соли на заряд катиона. В особом случае реакций неполного замещения атомов водорода в кислоте (образование кислых солей) величина z для кислоты равна количеству замещаемых в реакции атомов водорода. Аналогично в особом случае реакций неполного замещения ОН-групп в основании (образование основных солей) величина z для оснований равна количеству ОН-групп, замещаемых в данной реакции на кислотный остаток. Для веществ, вступающих в окислительно-восстановительные реакции, величина z равна произведению изменения степени окисления атома окислителя (восстановителя), входящего в состав вещества, на количество атомов этого элемента в формуле вещества. Так, при окислении металла величина z для металла равна степени его окисления в продукте реакции.
Оборудование и реактивы:
В лаборатории: штатив – 1 шт., лапа – 2 шт., кристаллизатор – 1 шт., колба Вюрца с присоединенной изогнутой стеклянной трубкой – 1 шт., резиновая пробка – 1 шт., фильтрованная бумага.
В вытяжном шкафу: соляная кислота – раствор концентрацией 1 моль/кг; мерный цилиндр, объемом 25 или 50 мл – 1 шт.
Получать в лаборантской: термометр – 1 шт., барометр – 1шт., бюретка объемом 25 мл – 1 шт., навеска исследуемого металла с указанной массой – 1 шт., полоска миллиметровой бумаги длиной 50 см (линейка).
Ход эксперимента:
1. Наполнить водой кристаллизатор и бюретку. Проверить, плотно ли закрыт кран бюретки.
2. Закрыв верхнее отверстие пальцем, перевернуть бюретку и опустить ее в кристаллизатор с водой таким образом, чтобы край бюретки был погружен в воду (при этом вода из бюретки не вытечет).
3. Закрепить бюретку в штативе. Уровень воды в самой бюретке не должен быть выше крайнего деления шкалы.
4. В колбу Вюрца при помощи мерного цилиндра отобрать 15-20 мл соляной кислоты.
5. Вытереть насухо горло колбы фильтром.
6. Расположив колбу горизонтально, поместить в ее горло навеску металла и плотно закрыть колбу пробкой.
7. Поместить присоединенную к боковому отводу колбы Вюрца стеклянную трубку в опущенный в воду конец бюретки.
8. После этого отметить уровень жидкости в бюретке. Показания следует снимать по положению нижнего края вогнутого мениска жидкости при нахождении его на уровне глаз. Цифры на шкале бюретки означают объем в мл, при снятии показаний необходимо учитывать, что бюретка со шкалой перевернута.
9. Затем колбу перевести в вертикальное положение, сбрасывая навеску металла в кислоту. В результате реакции выделяется водород, который вытесняет воду из бюретки. Во время протекания реакции не следует держать колбу в руках во избежание ее нагрева и искажения результатов за счет теплового расширения газа.
10. Когда выделение пузырьков водорода прекратится, отметить конечный уровень воды в бюретке.
11. При помощи полоски миллиметровой бумаги измерить высоту столба в бюретке от нижнего края мениска до уровня воды в кристаллизаторе.
12. По показаниям барометра и термометра определить температуру и атмосферное давление в помещении.
Протокол лабораторной работы:
Масса навеки металла, mМе = 0,08г
Объем воды в бюретке в начале эксперимента, V1= 20,4 мл
Объем воды в бюретке в конце эксперимента, V2= 11,5 мл
Объем выделившегося водорода, Vизм= V1-V2= 8,9 мл
Высота столба воды в бюретке, h= 24,8 см
Атмосферное давление в лаборатории, Pатм= 762 мм. рт. ст.
Температура в лаборатории, T= 23 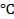
Обработка результатов эксперимента:
1. P= Pатм – P1- P2= 96307,62 Па
Pатм = 762*133,3=101574,6 Па
P1= daqgh= 1000*9,8*0,248=2430,4 Па
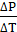 =
= 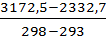 =
= 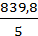 =167,96 Па/К
=167,96 Па/К
P2= 2332,7+ 3*167,96= 2836,58 Па
2. m (H2)= 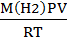 =
= 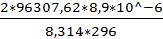 = 0,00069659270426 г
= 0,00069659270426 г
3. ƞ(H2)= ƞ(Ме)= 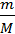 =
= 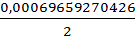 =0,00034829635213
=0,00034829635213
4. M(Me)=  =
= 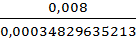 =22,9689458416 г/моль
=22,9689458416 г/моль
Нам известно, что валентность Ме равна двум, значит, вещество, с которым мы проводили опыт, – Mg.
5. Найдем относительную погрешность эксперимента:
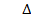 =
= 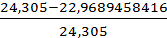 *100%=5,497%
*100%=5,497%
Вывод: я усвоила понятие о химическом эквиваленте и научилась определять эквивалентные массы веществ.