Нормирование качества воды.
Литература:
1. Фрог Б.Н., Левченко А.П. Водоподготовка: Учебн. пособие для вузов., М.: Изд-во МГУ, 1996.
2. Водоподготовка. Справочник для профессионалов. Под ред. С.Е. Беликова. М.: Аква-Терм, 2007.
3. Минц Д.М. Теоретические основы технологии оистки воды. М.: Стройиздат, 1964.
4. ГОСТ 30813-2002 Вода и водоподготовка. Термины и определения.
5. СНиП 2.04.02-84* Водоснабжение. Наружные сети и сооружения.
Свойства воды
Прежде чем переходить к изучению процессов обработки воды следует вспомнить, что же собой представляет вода?
Вода – самое аномальное вещество природы, свойства вод во многом не соответствуют физическим законам, которым подчиняются другие вещества.
Принятая сегодня модель воды – тетраэдр (по зарядам электронов).
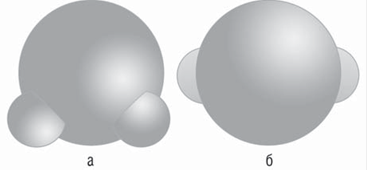
Однако одиночных молекул при нормальных условиях не существует. Предполагается, что кроме ионов Н+, ОН- и Н3О+ присутствуют также Н9О4+ и Н7О4-. При этом идёт реакция:
Н9О4++ Н7О4-=8Н2О
Изотопный состав воды
В природе встречаются три изотопа водорода и три – кислорода. Искусственно созданы два изотопа водорода и пять изотопов кислорода. Т.е. теоретически можно говорить о 135 различных по изотопному составу видов воды. Однако только 9 из них устойчивые, а в заметных количествах встречаются только 4 вида, % мол.:
- 1Н216О – 99,73;
- 1Н218О – 0,20;
- 1Н217О – 0,04;
- 1Н2Н16О ~ 0,03.
Другие изотопы присутствуют в ничтожном количестве.
Физические свойства воды
Полярная ассиметричная структура воды обуславливает её аномальные физические свойства. Так у воды аномально высокие удельная теплоёмкость, теплота испарения и температура плавления, температура кипения и температура замерзания. Максимальная плотность воды наблюдается при положительной температуре.
Можно сравнить свойства воды со свойствами других соединений подгруппы кислорода с водородом:
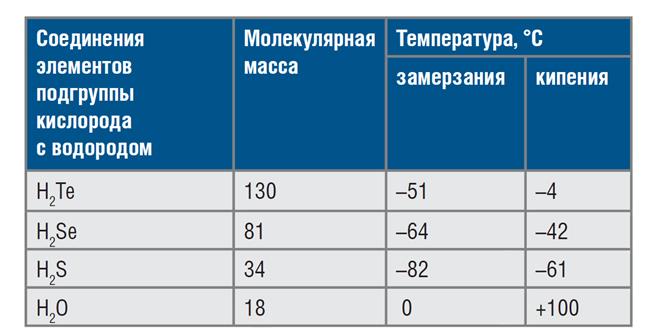
Т.е. вода должна кипеть примерно при -80°С, а замерзать при -100°С.
Максимальная плотность воды при +4°С, а при замерзании объём увеличивается на 10%.
Теплоёмкость воды вдвое превышает теплоёмкость любого другого химического соединения.
Ещё одно свойство – у воды исключительно большое поверхностное натяжение.
Природная вода как дисперсная система
До сих пор мы говорили с вами о химически чистой воде, которая в природе не встречается. Природная вода представляет собой сложную дисперсную систему. Различают гетерогенные системы (с границей раздела фаз) и гомогенные системы.

Принято считать, что гетерогенные системы существуют при размере частиц более 10-3 мкм. При более мелких частицах систему можно считать гомогенной.
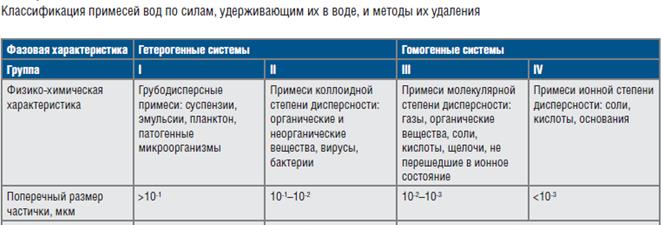
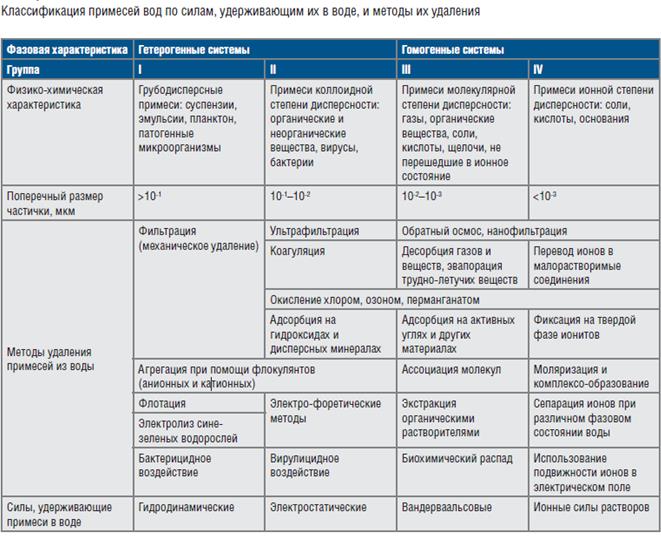
Показатели качества воды
Взвешенные вещества
Мутность и прозрачность
Мутность воды вызвана присутствием тонкодисперсных примесей, обусловленных нерастворимыми или коллоидными неорганическими и органическими веществами различного происхождения.
Нефелометрические единицы мутности НЕФ (NTU) – основано на рассеивании излучения
ЕМФ – ослабление потока излучения
Прозрачность (диск Секки, шрифт Снеллена)
Запах


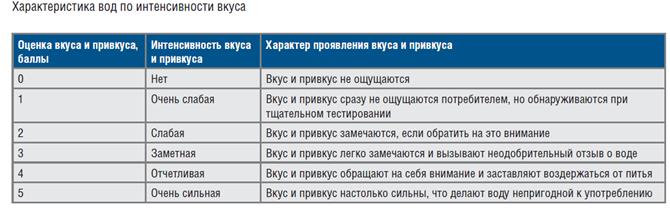
Вкус и привкус
Различают четыре вида вкуса: солёный
горький
сладкий
кислый
Цветность -
Показатель качества воды, характеризующий интенсивность окраски воды и обусловленный содержанием окрашенных соединений, выражается в градусах платино-кобальтовой шкалы и определяется путем сравнения окраски испытуемой воды с эталонами.
Минерализация (сухой остаток, электропроводность)
Минерализация – суммарное содержание всех найденных при химическом анализе воды минеральных веществ.
мг/дм3 или мкг/дм3
ppm или ppb
1 мг/дм3=1 ppm=103 ppb


Электропроводность – численное выражение способности водного раствора проводить электрический ток.
Сухой остаток
Прокалённый остаток
Жёсткость
Жесткость воды обусловливается наличием в воде ионов кальция (Са2+), магния (Mg2+), стронция (Sr2+), бария (Ва2+), железа (Fe3+), марганца (Mn2+).

Щёлочность
Щелочностью воды называется суммарная концентрация содержащихся в воде анионов слабых кислот и гидроксильных ионов (выражена в ммоль/л), вступающих в реакцию при лабораторных исследованиях с соляной или серной кислотами с образованием хлористых или сернокислых солей щелочных и щелочноземельных металлов.
Различают следующие формы щелочности воды: бикарбонатная (гидрокарбонатная), карбонатная, гидратная, фосфатная, силикатная, гуматная – в зависимости от анионов слабых кислот, которыми обусловливается щелочность.
Органические вещества
СанПиН 2.1.4.1074-01 «ПИТЬЕВАЯ ВОДА. ГИГИЕНИЧЕСКИЕ ТРЕБОВАНИЯ К КАЧЕСТВУ ВОДЫЦЕНТРАЛИЗОВАННЫХ СИСТЕМ ПИТЬЕВОГО ВОДОСНАБЖЕНИЯ. КОНТРОЛЬ КАЧЕСТВА»

Окисляемость воды: перманганатная
бихроматная (ХПК)
иодатная
цериевая
Также применяются БПК5 и БПК20;
общий органический углерод (ООУ)