МЕТОДЫОКИСЛЕНИЯ - ВОССТАНОВЛЕНИЯ (РЕДОКСИМЕТРИЯ)
В редоксиметрии используются реакции окисления - восстановления, связанные с переходом электронов от одного иона (молекулы) к другому. Вещество, теряющее электроны, в этих реакциях является восстановителем, а приобретающее - окислителем; первое вещество окисляется, а второе - восстанавливается. Следствием такого перераспределения электронов является изменение степени окисления соответствующих атомов, молекул или ионов, причем степень окисления восстанавливающихся веществ понижается, а окисляющихся - повышается. Например, превращения Fe2+ в Fe3+, С1– в С12, Сu в Сu2+ представляют собой окисление, поскольку степень окисления возрастает (Fe2+ и С1– теряют по одному электрону, а Сu2+ отдает 2 электрона).
Представить направление окислительно-восстановительной реакции можно, только зная количественную характеристику относительной силы окислительно-восстановительной системы. Такой характеристикой является величина окислительно-восстановительного потенциала.
При погружении какого-либо металла в водный раствор, содержащий катионы этого металла, катионы из кристаллической решетки металла способны частично перейти в близлежащий слой раствора (процесс окисления) и, наоборот, небольшая часть катионов из раствора способна разряжаться и выделяться на металле (процесс восстановления). Как только скорости этих двух противоположно направленных электрохимических реакций становятся равными, устанавливается динамическое равновесие, при котором в единицу времени столько ионов покидает металл, сколько разряжается на нем. В зависимости от того, какой процесс преобладает, на металле возникает избыток положительных или отрицательных зарядов, а раствор вблизи поверхности металла получает противоположный заряд. Следствием этого является возникновение разности потенциалов на поверхности раздела металл - раствор. Непосредственно измерить разность потенциалов между металлом и раствором очень трудно,но легко измерить разность потенциалов между двумя такими системами, соединив их в гальванический элемент. Любой гальванический элемент состоит из двух полуэлементов, каждый из которых представляет собой окислительно-восстановительную пару, т. е. систему, состоящую из окисленной и восстановленной формы данного химического элемента или иона.

Схема прибора для определения стандартного и окислительного потенциала пары Fe3+/Fe2+: 1, 2 - стеклянные сосуды; 3 - электролитический ключ; 4 - трубка для пропускания водорода; 5 - потенциометр.
При экспериментальном определении окислительных потенциалов различных пар приходится учитывать, что величина их зависит не только от силы входящих в состав данной пары окислителя и восстановителя, но и от отношения их концентрации (точнее, активностей). Для получения сравнимых результатов необходимо сделать концентрации одинаковыми, в общем случае равными единице. Получающиеся при этом окислительные потенциалы называются стандартными (нормальными) окислительно-восстановительными потенциалами и обозначаются через Е°.
Более точно стандартным называется тот потенциал, который данная окислительно-восстановительная система имеет при концентрации, равной единице всех компонентов, участвующих в окислительно-восстановительном процессе на электроде. В этом случае ln([Ок]/[Вос]) = 0 и E = E°.
Для получения сравнимых результатов необходимо при определении стандартных потенциалов разные окислительно-восстановительные пары комбинировать всегда с одной и той же стандартной парой. Для этого употребляют так называемый нормальный водородный электрод, представляющий собой пару 2Н+/Н2 при концентрации Н+, равной 1 моль/л, и давлении газообразного водорода, равном 1 атм. В сосуд 1 помещают раствор H2SO4 требуемой концентрации и погружают в него платиновый электрод, покрытый слоем мелкодисперсной платины («платиновая чернь»). В раствор по трубке 4пропускают химически чистый водород, который, соприкасаясь с платиновым электродом, адсорбируется мелкодисперсной платиновой чернью. Поэтому электрод действует так, как если бы он был сделан из водорода. Потенциал стандартного водородного, электрода условно принят равным нулю.
При определении стандартного потенциала какой-либо данной пары, например Fe3+/Fe2+, ее комбинируют со стандартным водородным электродом в гальванический элемент, как показано на рис. 56.
В сосуд 2помещают смесь равных объемов растворов FeCl3 и FeC2 одинаковых молярных концентраций и погружают в нее платиновый электрод. Оба электрода соединяют проводником, включив в цепь прибор 5для измерения э. д. с. (потенциометр). Растворы соединяют U-образной трубкой 3с раствором электролита (КС1). По трубке 3, называемой «электролитическим ключом», ионы диффундируют из одного сосуда в другой (при этом замыкается внутренняя цепь).
Отрицательным полюсом такого элемента является стандартный водородный электрод, положительным полюсом - платиновый-электрод; на первом происходит процесс отдачи электронов молекулами Н2 платине, т. е. реакция окисления их до Н+:
Н2 - 2е «2Н+
Освобождающиеся при этом электроны перетекают по проводнику к платиновому электроду, где их присоединяют Fе3+-ионы, восстанавливающиеся до Fe2+:
2Fe3+ + 2е «2Fe2+
Сложив почленно оба написанных уравнения, получим общее уравнение реакции, происходящей при работе данного элемента:
2Fe3+ + H2 «2Fe2+ + 2H+
Электродвижущая сила (э. д. с.) этого элемента оказывается равной 0,77 в. Поскольку же она представляет собой разность стан дартных потенциалов обеих пар, можно написать:

Но величина Е° 2H+/H2 условно принята за нуль. Следовательно
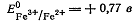
Знак плюс показывает, что данная пара играет при комбинировании ее со стандартным водородным электродом роль положительного полюса. Наоборот, если она является отрицательным полюсом (т. е. при работе элемента отдает электроны Н+-ионам, восстанавливая их до Н2), то потенциал ее считается отрицательным. Полученная для пары Fe3+/Fe2+ величина стандартного потенциала (+0,77 в) является мерой способности Fe3+-uoнoв отнимать электроны от молекул Н2, т. е. окислять их до ионов Н+.
Если вместо пары Fe3+/Fe2+ скомбинировать стандартный водородный электрод с парой Сl2/2С1-, то получится элемент, работу которого можно изобразить схемой:
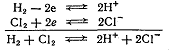
Величина стандартного потенциала пары Сl2/2С1- оказывается значительно большей, чем пары Fe3+/Fe2+, она равна  . Следовательно, сродство к электронам (т. е. окислительная активность) у Сl2 значительно больше, чем у Fe3+. Соответственно С1- является более слабым восстановителем, чем Fe2+. Таким образом, чем больше стандартный потенциал данной пары, тем более сильным окислителем является ее окисленная форма и тем более слабым восстановителем - восстановленная форма.
. Следовательно, сродство к электронам (т. е. окислительная активность) у Сl2 значительно больше, чем у Fe3+. Соответственно С1- является более слабым восстановителем, чем Fe2+. Таким образом, чем больше стандартный потенциал данной пары, тем более сильным окислителем является ее окисленная форма и тем более слабым восстановителем - восстановленная форма.
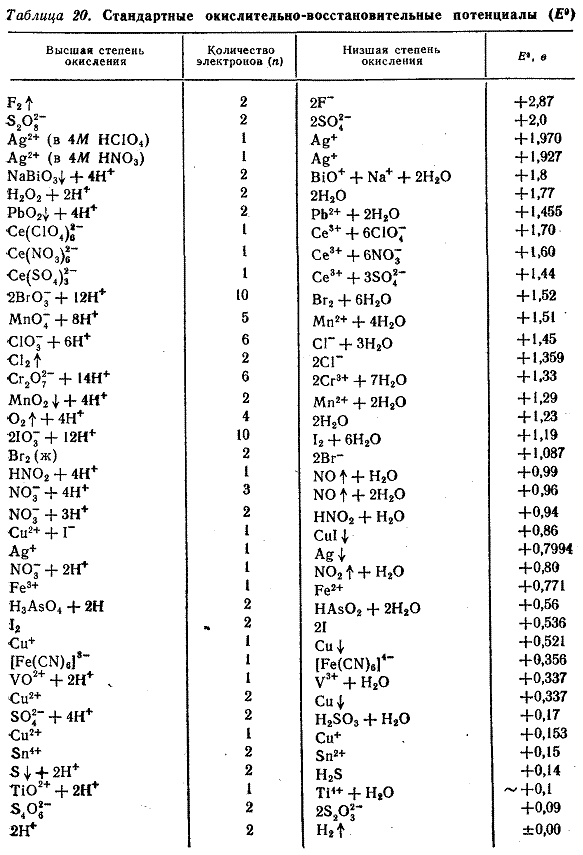
Величины стандартных потенциалов различных пар, имеющих значение в количественном анализе, приведены в табл. В первой и третьей графах этой таблицы даны формулы отдельных компонентов различных пар, эти компоненты расположены в порядке уменьшения соответствующих им стандартных потенциалов Е° (четвертая графа). Во второй графе указано число электронов (n), получаемых окислителем (первая графа) при превращении его в соответствующий восстановитель (третья графа).
Возрастание величин стандартных потенциалов соответствует увеличению силы окислителей и уменьшению силы восстановителей, поэтому самые сильные окислители помещены в начале первой графы, а наиболее сильные, восстановители - в конце третьей графы таблицы стандартных потенциалов. Например, сильнейшим из всех окислителей является фтор, которому соответствует наибольшая величина Е° (+2,87 в). К наиболее сильным восстановителям относятся щелочные и щелочноземельные металлы, а также Mg, Al, Zn и другие. Ионы F- практически совсем не обладают восстановительными свойствами, так как нет такого окислителя, который мог бы отнять у них электроны. Отнять электроны у F- иohob можно только путем электролиза.
Когда комбинируются две какие-либо окислительно-восстановительные пары, то более сильный из двух окислителей отнимает электроны у более сильного восстановителя, причем образуются более слабые восстановитель и окислитель. Например, из двух пар: С12/2С1- и Fe3+/Fe2+ - более сильным окислителем является С12 Е°= +1,36 в), а более сильным восстановителем - Fе2+-ионы, (Е°= +0,77 в). В соответствии с этим реакция между указанными парами идет в направлении
Cl2 + 2Fe2+ →2C- + 2Fe3+
т. е в сторону образования более слабых восстановителя (Cl-) и окислителя (Fe3+), чем исходные.
Приведенное правило можно формулировать также следующим образом: окислители, принадлежащие к окислительно-восстановительным системам с большими стандартными потенциалами, способны окислять люоые восстановители, являющиеся компонентами окислительно-восстановительных систем с меньшими стандартными потенциалами.
Так, МnО4- в кислой среде (Е°= -l,51 в) может окислять все стоящие ниже (в третьей графе) восстановители, например Сl-, Вr-, Fe2+ и т.д.
Рассматриваемое правило дает возможность, пользуясь таблицей стандартных потенциалов, предвидеть направление течения различных окислительно-восстановительных реакций, выбирать подходящие окислители и восстановители и решать ряд других важных для аналитической практики вопросов.