Общая характеристика,
Строение и физические свойства
Алканов.
Предельные углеводороды (алканы, парафи-
ны) — соединения, состоящие только из атомов углерода
и водорода, в которых все атомы связаны простыми
связями. Простейшим предельным
углеводородом является метан CH4. Каждый
последующий углеводород этого ряда отличается от
предыдущего на группу —CH2 (гомологическая
разность). Подобные ряды называются гомологи-
ческими. Представители гомологических рядов —
гомологи. Общая формула для предельных углеводородов
сnн2n+2.
Строение. Атом углерода в предельных углеводородах
находится в sp 3 гибридизированном
состоянии.
физические свойства. В гомологическом ряду наблюдается
постепенное изменение физических свойств
углеводородов: повышаются температуры кипения и
плавления, повышается плотность. Алканы нормального
строения кипят при более высокой температуре,
чем алканы разветвленного. При обычных условиях
СН4, С2Н6, С3Н8, С4Н10 — газы, с С5Н12 до С16Н34 —
жидкости, а с С17Н36 — твердые вещества.
Способы получения
Алканов:
- гидрирование алкенов: CnH2n + H2 → CnH2n+2
- (реакция Вюрца): 2R—Br + 2Na = R—R + 2NaBr
- восстановление галогеналканов: R—CH2Cl + H2 → R—CH3 + HCl
№29
Общая характеристика, изомерия,
Номенклатура, физические свойства
Циклоалканов.
циклоалканы — предельные углеводороды, содержащие
циклы из атомов углерода.
Имеют общую формулу СnH2n. Атомы углерода
находятся в sp 3гибридизации.
В природе находятся в составе нефти,
эфирных масел.
номенклатура. Названия насыщенных моноциклических
углеводородов образуют добавлением префикса
-цикло к названию
алкана с тем же
числом углеродных атомов. При наличии в цикле заместителей
нумерацию атомов углерода в кольце
проводят так, чтобы ответвления получили возможно
меньшие номера.
физические свойства. С3Н8 и С4Н8 — газы, с С5Н10
до С10Н20 — жидкости, с С11Н22 — твердые, плохо растворимые
в воде, легко — в органических растворителях.
Температуры кипения и плавления выше, чем у
алканов.
Способы получения циклоалканов.
Химические свойства циклоалканов
- гидрирование бензола: 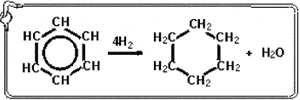
- циклическое дегалогенирование: 
№33
Этиленовые углеводороды (алкены)
— углеводороды, в молекулах которых имеется
одна двойная связь C=С. Общая формула CnH2n.
изомерия алкенов:
а) изомерия углеродного скелета;
б) изомерия положения кратной связи;
номенклатура. Названия образуются заменой
суффикса ациклического насыщенного неразветвленного
углеводорода -ан на -ен. Двойная связь входит
в родоначальную структуру, цепь нумеруют со стороны
двойной связи.
строение. Атом углерода в этиленовых углеводородах
находится в sp 2гибридизированном
состоянии.
физические свойства. Первые три члена гомологического
ряда алкенов — газы, углеводороды от C4
до C16 — жидкости, высшие алкены — твердые вещества.
способы получения алкенов
1. крекинг нефти (промышленный метод)
4. дегидрогалогенирование галогеналканов:
CH3—CH2—CH2—I + KOH → CH3—CH=CH2 + KI + H2O
5. реакция дегидратации спиртов:
CH3—CH2—CH2—OH → CH3—CH=CH2 + H2O
6. дегалогенирование дигалогеналканов: 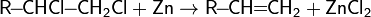
№35
Окисление алкенОв
2. гидроксилирование. Взаимодействие алкенов
и разбавленных водных растворов КMnO4 при pH > 7
и комнатной температуре идет с образованием двухатомных
спиртов — диолов (мягкое окисление по
Вагнеру):
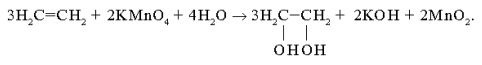
3. Озонолиз (окисление озоном).
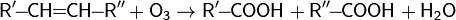
№36