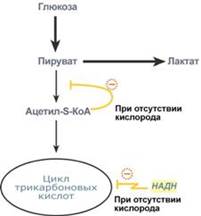
Эффект Пастера
Это снижение потребления глюкозы и прекращение продукции молочной кислоты клеткой в присутствии кислорода. Биохимический механизм эффекта заключается в конкуренции за пируват между пируватдегидрогеназой, превращающей пируват в ацетил-S-КоА, и лактатдегидрогеназой, превращающей пируват в лактат.
У пируватдегидрогеназы сродство гораздо выше и в обычных аэробных условиях она окисляет большую часть пировиноградной кислоты. Как только поступление кислорода уменьшается (недостаток кровообращения, тромбоз и т.п.) происходит следующее:
внутримитохондриальные процессы дыхания не идут и НАДН в дыхательной цепи не окисляется, моментально накапливающийся в митохондриях НАДН тормозит цикл трикарбоновых кислот, ацетил-S-КоА не входит в ЦТК и ингибирует ПВК-дегидрогеназу.
В этой ситуации пировиноградной кислоте не остается ничего иного как превращаться в молочную.
При наличии кислорода ингибирование ПВК-дегидрогеназы прекращается и она, обладая большим сродством к пирувату, выигрывает конкуренцию.
31. Гиколиз: окислительно –восстановительные реакции, сопряженные с фосфорилированием АДФ. Челночные механизмы окисления гликолитического НАДН
Гликолиз (от греч. glycys – сладкий и lysis – растворение, распад) – это последовательность ферментативных реакций, приводящих к превращению глюкозы в пируват с одновременным образованием АТФ.
При аэробных условиях пируват проникает в митохондрии, где полностью окисляется до СО2 и Н2О. Если содержание кислорода недостаточно, как это может иметь место в активно сокращающейся мышце, пируват превращается в лактат.
Итак, гликолиз – не только главный путь утилизации глюкозы в клетках, но и уникальный путь, поскольку он может использовать кислород, если последний доступен (аэробные условия), но может протекать и в отсутствие кислорода (анаэробные условия).
Челночные механизмы. Десять ферментов, катализирующих распад глюкозы до стадии пирувата, локализованы в цитозоле; все остальные — в митохондриях. В числе первых десяти реакций есть дегидрирование с участием НАД+. Образующийся здесь НАДН не может передавать водород непосредственно на дыхательную цепь, поскольку митохондриальная мембрана непроницаема для НАДН. Перенос водорода с цитозольного НАДН в митохондрии происходит при участии специальных механизмов, называющихся челночными. Суть этих механизмов сводится к тому, что НАДН в цитозоле восстанавливает некоторое соединение, способное проникать в митохондрию; в митохондрии это соединение окисляется, восстанавливая внутримитохондриальный НАД, и вновь переходит в цитозоль.
Биосинтез и распад гликогена: ферментативные реакции, физиологическое значение.
Регуляция активности гликогенсинтазы и гликогенфосфорилазы.
Гликоген – главная форма запасания углеводов у животных и человека. Накапливается гликоген главным образом в печени (до 6% от массы печени) и в скелетных мышцах, где его содержание редко превышает 1%. Запасы гликогена в скелетных мышцах ввиду значительно большей массы последних превышают его запасы в печени. Гликоген присутствует в цито-золе в форме гранул диаметром от 10 до 40 нм. На электронных микрофотографиях гликогеновые гранулы выглядят плотными. Установлено, что эти гранулы, кроме гликогена, содержат ферменты, катализирующие синтез и распад гликогена. Однако гликогеновые гранулы отличаются от мульти-ферментных комплексов (например, от пируватдегидрогеназного комплекса). Степень структурной организации гликогеновых гранул ниже, чем в мультиферментных комплексах. Следует подчеркнуть, что синтез и распад гликогена в клетке осуществляются разными метаболическими путями.
В частности, считалось, что гликогенфосфорилаза (фосфорилаза а) катализирует как распад гликогена, так и его синтез, потому что в опытах in vitro было показано, что гликогенфосфорилазная реакция обратима. Однако в дальнейшем было установлено, что в клетке (in vivo) фосфорилаза а катализирует только распад гликогена, синтез гликогена осуществляется при участии совершенно другого фермента. Оба эти процесса (синтез и распад гликогена) регулируют содержание глюкозы в крови и создают резерв глюкозы для интенсивной мышечной работы.
33.Роль гормонов(инсулина, глюкагона, адреналина) в регуляции обмена гликогена в печени. Механизмы реципрокной регуляции гликогенолиза и гликогенеза за счет каскадного цАМФ- зависимого фосфорилирования ферментативных белков.
Инсулин - белковый гормон, синтезируется и секретируется в кровь р-клетками островков Лангерханса поджелудочной железы, β-клетки чувствительны к изменениям содержания глюкозы в крови и секретируют инсулин в ответ на повышение её содержания после приёма пищи. Транспортный белок (ГЛЮТ-2), обеспечивающий поступление глюкозы в β-клетки, отличается низким сродством к ней. Следовательно, этот белок транспортирует глюкозу в клетку поджелудочной железы лишь после того, как её содержание в крови будет выше нормального уровня (более 5,5 ммоль/л).
В β-клетках глюкоза фосфорилируется глюкокиназой, имеющей также высокую Кm для глюкозы - 12 ммоль/л. Скорость фосфорилирования глюкозы глюкокиназой в β-клетках прямо пропорциональна её концентрации в крови.
Синтез инсулина регулируется глюкозой. Глюкоза (или её метаболиты), по-видимому, непосредственно участвуют в регуляции экспрессии гена инсулина. Секреция инсулина и глюкагона также регулируется глюкозой, которая стимулирует секрецию инсулина из β-клеток и подавляет секрецию глюкагона из α-клеток. Кроме того, сам инсулин снижает секрецию глюкагона.
Глюкагон - "гормон голода", вырабатываемый α-клетками поджелудочной железы в ответ на снижение уровня глюкозы в крови. По химической природе глюкагон - пептид.
Адреналин выделяется из клеток мозгового вещества надпочечников в ответ на сишалы нервной системы, идущие из мозга при возникновении экстремальных ситуаций (например, бегство или борьба), требующих внезапной мышечной деятельности.
Адреналин является сигналом "тревоги". Он должен мгновенно обеспечить мышцы и мозг источником энергии.
34. Переваривание и всасывание углеводов в желудочно- кишечном тракте. Транспорт моносахаридов из кишечника в кровь.
Моносахариды всасываются в тонком кишечнике путем активного транспорта без предварительного расщепления на меньшие фрагменты. Дисахариды предварительно расщепляются до моносахаридов под влиянием соответствующих дисахаридаз — сахаразы, лактазы и мальтазы, секретируемых в кишечнике, и всасываются, в основном, в виде моносахаридов.
В то же время переваривание полисахаридов носит многоступенчатый характер. Переваривание крахмала — основного углевода пищевых продуктов — начинается уже в ротовой полости под влиянием амилазы слюны, активной в условиях нейтрального или слабощелочного рН слюны. Однако кратковременность пребывания пищи в ротовой полости и относительно низкая активность амилазы слюны делают этот этап переваривания крахмала малоэффективным. Основным местом переваривания крахмала служит 12-перстная кишка, где крахмал расщепляется до декстринов (продуктов деполимеризации крахмала) под влиянием высокоактивной -амилазы поджелудочной железы.
Эффективность расщепления крахмала под влиянием амилазы и глюкоамилазы зависит от ряда факторов, касающихся как особенностей формы крахмала в пищевых продуктах, так и функционального состояния желудочно-кишечного тракта.

Всасывание моносахаридов из кишечника в кровь осуществляется путем облегченной диффузии. Если концентрация глюкозы в кишечнике невелика, то ее транспорт может происходить за счет градиента концентрации ионов натрия, создаваемого Na+, K+—AТР—азой.
35. Транспорт глюкозы из крови в клетки. Внутриклеточный метаболизм глюкозы.
Преобладающим моносахаридом, образующимся в результате переваривания пищевых углеводов, является глюкоза, поскольку крахмал представляет собой полимер глюкозы, и пищевые дисахариды — сахароза и лактоза — наполовину построены тоже из глюкозы. Поступающая из просвета кишечника глюкоза с кровью воротной вены попадает в печень, где часть ее задерживается, а часть через общий кровоток попадает в клетки других органов и тканей.
Потребление глюкозы клетками происходит при участии специальных белков-переносчиков (их называют также рецепторами глюкозы), образующих гидрофильные трансмембранные каналы. Существует два основных механизма переноса глюкозы: активный транспорт, зависящий от градиента концентраций Na+ (см. выше), и облегченная диффузия. Соответственно есть два основных типа рецепторов глюкозы. Рецепторы, зависимые от Na+, обнаруживаются только в почках и кишечнике и обеспечивают реабсорбцию глюкозы из почечных канальцев и всасывание из люмена кишечника против градиента концентрации. Рецепторы облегченной диффузии (транспортеры глюкозы, ГЛЮТ) есть во всех тканях.
В тканях человека обнаружено пять разных ГЛЮТ:
□ ГЛЮТ-1 — в плаценте, мозге, почках, толстом кишечнике, в (3-клетках панкреатических островков; меньше — в жировой ткани и мышцах;
□ ГЛЮТ-2 — преимущественно в печени, в энтероцитах, в проксимальных тубулярных клетках почек (все эти клетки выделяют глюкозу в кровь); в [3-клетках панкреатических островков (возможно, участвует в стимуляции глюкозой секреции инсулина);
□ ГЛЮТ-3 — во многих тканях, включая мозг, плаценту, почки;ГЛЮТ-4 — единственный переносчик, регулируемый инсулином; содержится только в скелетных и сердечной мышцах и жировой ткани (инсулиноза-висимые ткани);
□ ГЛЮТ-5 — вероятно, главный переносчик глюкозы в базальном состоянии, т. е. при отсутствии стимуляции инсулином.
Все рецепторы могут находиться как в плазматической мембране клетки, так и в мембранных везикулах в цитоплазме. Количество рецепторов 1, 2, 3 и 5 в плазматической мембране изменяется в узких пределах и не зависит от коцентрации инсулина. Напротив, ГЛЮТ-4 (и в гораздо меньшей мере ГЛЮТ-1) в отсутствие инсулина практически полностью находится в цитозольных везикулах. Стимуляция клеток инсулином приводит к перемещению везикул к плазматической мембране и их слиянию, в результате чего рецепторы оказываются встроенными в плазматическую мембрану (рис. 9.4). При этом, как показано в экспериментах с жировыми и мышечными клетками, скорость потребления глюкозы увеличивается в 30-40 раз. При снижении концентрации инсулина в среде рецепторы вновь возвращаются в цитозоль.
36. Механизм β- окисления жирных кислот. Ферменты β- окисления,их коферменты. Локализация в клетке. Роль карнитина в транспорте жирных кислот в митохондрии. Энергетический баланс β- окисления жирных кислот.
Окисление жирных кислот (β-окисление)
Для преобразования энергии, заключенной в жирных кислотах, в энергию связей АТФ существует метаболический путь окисления жирных кислот до СО2 и воды, тесно связанный с циклом трикарбоновых кислот и дыхательной цепью. Этот путь называется β-окисление, т.к. происходит окисление 3-го углеродного атома жирной кислоты (β-положение) в карбоксильную группу, одновременно от кислоты отщепляется ацетильная группа, включающая С1 и С2 исходной жирной кислоты.

Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие в цитозоль из крови или появляющиеся при липолизе собственных внутриклеточных ТАГ. Суммарное уравнение окисления пальмитиновой кислоты выглядит следующим образом:
Пальмитоил-SКоА + 7ФАД + 7НАД+ + 7Н2O + 7HS-KoA → 8Ацетил-SКоА + 7ФАДН2 + 7НАДН
Этапы окисления жирных кислот
1. Прежде, чем проникнуть в матрикс митохондрий и окислиться, жирная кислота должна активироваться в цитозоле. Это осуществляется присоединением к ней коэнзима А с образованием ацил-S-КоА. Ацил-S-КоА является высокоэнергетическим соединением. Необратимость реакции достигается гидролизом дифосфата на две молекулы фосфорной кислоты.

Реакция активации жирной кислоты
2. Ацил-S-КоА не способен проходить через митохондриальную мембрану, поэтому существует способ его переноса в комплексе с витаминоподобным веществом карнитином. На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I.
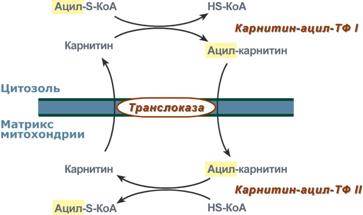
Карнитин-зависимый транспорт жирных кислот в митохондрию
3. После связывания с карнитином жирная кислота переносится через мембрану транслоказой. Здесь на внутренней стороне мембраны фермент карнитин-ацилтрансфераза II вновь образует ацил-S-КоА который вступает на путь β-окисления.
4. Процесс собственно β-окисления состоит из 4-х реакций, повторяющихся циклически. В них последовательно происходит окисление (ацил-SКоА-дегидрогеназа), гидратирование (еноил-SКоА-гидратаза) и вновь окисление 3-го атома углерода (гидроксиацил-SКоА-дегидрогеназа). В последней, трансферазной, реакции от жирной кислоты отщепляется ацетил-SКоА. К оставшейся (укороченной на два углерода) жирной кислоте присоединяется HS-КоА, и она возвращается к первой реакции. Все повторяется до тех пор, пока в последнем цикле не образуются два ацетил-SКоА.
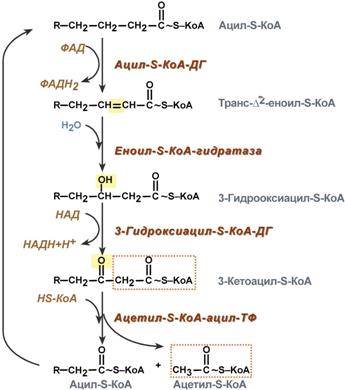
Расчет энергетического баланса β-окисления
При расчете количества АТФ, образуемого при β-окислении жирных кислот необходимо учитывать:
- количество образуемого ацетил-SКоА – определяется обычным делением числа атомов углерода в жирной кислоте на 2.
- число циклов β-окисления. Число циклов β-окисления легко определить исходя из представления о жирной кислоте как о цепочке двухуглеродных звеньев. Число разрывов между звеньями соответствует числу циклов β-окисления. Эту же величину можно подсчитать по формуле (n/2 -1), где n – число атомов углерода в кислоте.
- число двойных связей в жирной кислоте. В первой реакции β-окисления происходит образование двойной связи при участии ФАД. Если двойная связь в жирной кислоте уже имеется, то необходимость в этой реакции отпадает и ФАДН2 не образуется. Количество необразованных ФАДН2 соответствует числу двойных связей. Остальные реакции цикла идут без изменений.
- количество энергии АТФ, потраченной на активацию (всегда соответствует двум макроэргическим связям).
Пример. Окисление пальмитиновой кислоты
- так как имеется 16 атомов углерода, то при β-окислении образуется 8 молекул ацетил-SКоА. Последний поступает в ЦТК, при его окислении в одном обороте цикла образуется 3 молекулы НАДН, 1 молекула ФАДН2 и 1 молекула ГТФ, что эквивалентно 12 молекулам АТФ. Итак, 8 молекул ацетил-S-КоА обеспечат образование 8×12=96 молекул АТФ.
- для пальмитиновой кислоты число циклов β-окисления равно 7. В каждом цикле образуется 1 молекула ФАДН2 и 1 молекула НАДН. Поступая в дыхательную цепь, в сумме они "дадут" 5 молекул АТФ. Таким образом, в 7 циклах образуется 7×5=35 молекул АТФ.
- двойных связей в пальмитиновой кислоте нет.
- на активацию жирной кислоты идет 1 молекула АТФ, которая, однако, гидролизуется до АМФ, то есть тратятся 2 макроэргические связи или две АТФ.
Таким образом, суммируя, получаем 96+35-2 =129 молекул АТФ образуется при окислении пальмитиновой кислоты.