Кафедра химии
Адсорбция вещества из газа на твердом адсорбенте
Лабораторная работа №5
по дисциплине «Физическая и коллоидная химия»
специальность
специализация
Проверил Выполнили
к.х.н.,доцент студенты группы ТЖМПЗ-092
____________ С.Г.Константинов ______________________
______________________
______________________
______________________
______________________
«____» ____________2012г. «____»____________ 2012 г.
Могилев 2012
1. Цель работы – познакомиться с основными закономерностями процессов адсорбции газа на твердой поверхности и научиться обрабатывать экспериментальные данные по адсорбции – вручную и на ЭВМ. Определить коэффициенты изотермы адсорбции Лэнгмюра. Рассчитать удельную поверхность адсорбента sуд.
2.Работа выполняется на ЭВМ по имеющейся программе.
3. Теоретическое введение.
В процессах физической адсорбции можно говорить о быстром установлении равновесия, положение которого определяется, в соответствии с принципом Ле-Шателье, температурой T, концентрацией (давлением) адсорбата P и величиной адсорбции (a). Величина адсорбции или просто адсорбция (a) измеряется в расчете на грамм адсорбента (удельная адсорбция aуд) в граммах адсорбата (г/г) или в моль/г (ммоль/г). Также используется безразмерная величина Θ = a /aпред – степень адсорбции. Здесь aпред – предельная адсорбция, т.е. максимальная адсорбция при условии, что вся поверхность адсорбента, доступная для адсорбции, занята молекулами адсорбата.
В соответствии с теорией Лэнгмюра, при адсорбции на поверхности адсорбента образуется лишь мономолекулярный слой адсорбата, т.е. нескомпенсированные межмолекулярные силы адсорбента практически насыщаются одним слоем адсорбированных молекул. Такая адсорбция характеризуется достаточно большим тепловым эффектом и по своей природе соответствует слабой хемосорбции. Предполагается, что по мере увеличения адсорбции величина теплового эффекта остается постоянной – это соответствует предположению, что поверхность адсорбента энергетически однородна и что адсорбируемые молекулы не взаимодействуют между собой. Оба эти предположения сильно упрощают картину адсорбции, тем не менее, получаемое уравнение (изотерма адсорбции Лэнгмюра) часто вполне удовлетворительно описывает экспериментальные данные и широко применяется в практических расчетах в силу его простоты и удобства вычислений.
Запишем процесс адсорбции в форме химической реакции:
[S] + (A) ↔ [SA] (1)
[свободная поверхность] + (адсорбат) ↔ [адсорбционный комплекс]
1 – Θ P Θ
Эта реакция записана для адсорбции газа на твердой поверхности, однако аналогичные соотношения могут быть получены и для адсорбции из раствора, если использовать активность или концентрацию (C) растворенного вещества.
В уравнении (1) [SA] – как бы поверхностное химическое соединение, образованное молекулами адсорбата (A) с твердой поверхностью [S]; будем его называть адсорбционным комплексом. Концентрацию этого комплекса на поверхности будем считать равной степени адсорбции Θ. Эта безразмерная величина показывает долю поверхности, занятой адсорбционным комплексом, и по своему смыслу аналогична молярной доле вещества в газе или растворе. Тогда величина 1 – Θ показывает долю свободной поверхности.
Предположим, что в рассматриваемой системе (1) установилось химическое равновесие. Константа равновесия этого процесса должна включать активности (в идеальной системе – концентрации) всех ее участников. Как и для идеальных растворов будем предполагать, что активность адсорбированного вещества, образующего с адсорбентом поверхностный адсорбционный комплекс, равна молярной доле этого вещества на поверхности, т.е. Θ. Тогда активность свободной поверхности будет равна 1 – Θ. Активность газа равна P (атм). Таким образом, получаем следующее выражение для константы равновесия K процесса адсорбции (1):

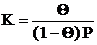 . (2)
. (2)
После простых преобразований получаем:
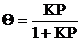 ,
,
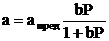 . (3)
. (3)
Уравнение (3) есть уравнение (или изотерма) адсорбции Лэнгмюра, в нем величина K, как это исторически принято, заменена на константу b. Таким образом, константа b в уравнении Лэнгмюра является по своему смыслу константой равновесия процесса адсорбции (1). В изотермических условиях она должна быть постоянной, не должна зависеть от a и P. Вместе с тем, она сильно зависит от температуры – с ее повышением равновесие (1) смещается, по принципу Ле-Шателье, влево, в сторону эндотермического процесса десорбции, а константа b при этом быстро уменьшается.
Вторая константа уравнения Лэнгмюра – aпред. Из уравнения (3) следует, что a → aпред при P → ∞. Поскольку при нагревании вещество, находящееся на поверхности, расширяется (твердая поверхность также расширяется, но в меньшей степени), константа aпред при повышении температуры несколько уменьшается.
По результатам выполнения работы строится график a – P – изотерма адсорбции. На этот график наносится также величина aпред.
На рис.1 показан характер кинетических кривых a – t (время) в процессе установления адсорбционного равновесия при двух разных температурах (T1< T2). В соответствии с законами смещения равновесия, равновесная величина aпред2 будет меньше, чем aпред1. В то же время при повышении температуры увеличивается скорость достижения равновесия адсорбции и кривая (2) на начальном участке идет выше и круче, чем кривая (1). Поэтому эти две кривые пересекаются в некоторой точке tx.
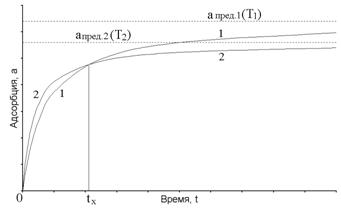
Рис. 1 Кинетические кривые адсорбции при двух разных температурах, T2 >T1
Правее этой точки преобладает влияние величины равновесной адсорбции, левее – преобладает влияние кинетических факторов. Исследования подобных кинетических кривых очень важны с точки зрения оптимизации технологических процессов и достижения максимального извлечения целевого компонента из потока газа, проходящего через слой адсорбента.
Из общих принципов смещения равновесия могут быть нарисованы и другие графики, используемые при рассмотрении процессов адсорбции – изобара (P = const, рис.2) (или изопикна, C = const – для растворов) и изостера (a = const, рис.3).
При постоянном давлении адсорбата (рис.2) адсорбция с ростом температуры уменьшается, равновесие (1) смещается влево – в сторону эндотермического процесса десорбции.
При постоянной адсорбции (рис.3) величины Θ и 1 – Θ в уравнении реакции (1) с увеличением температуры остаются постоянными, поэтому смещение равновесия влево возможно только за счет увеличения давления адсорбата.
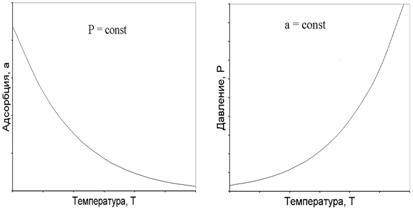
Рис. 2 – Изобара адсорбции Рис. 3 – Изостера адсорбции
Для определения констант уравнения Лэнгмюра (3) исходные данные необходимо обработать методом наименьших квадратов на ЭВМ или графическим методом (вручную). С этой целью преобразуем уравнение (3):
1/a = 1/aпред + 1/(aпредb)∙1/P = А + В·1/Р. (4)
Уравнение (4) соответствует прямой линии в координатах 1/a – 1/P, причем на соответствующем графике отрезок, отсекаемый на оси ординат, равен 1/aпред, а из тангенса угла наклона и величины aпред определяется коэффициент b.
Найденное значение aпред (моль/г) позволяет рассчитать удельную поверхность адсорбента sуд (поверхность, приходящуюся на 1 г адсорбента), если известна площадь s1, занимаемая в адсорбционном слое одной молекулой (посадочная площадка молекул адсорбата):
sуд = aпред s1 NA, (5)
где NA – число Авогадро.
4. Методика выполнения (ход работы).
В «Методических указаниях» [2] по двум последним цифрам номера зачетной книжки определяют исходные данные для расчетов на ЭВМ – пять пар величин Р(мм рт. ст.) – а (г/г), молярную массу адсорбата М и посадочную площадку молекул адсорбата s1.
Запускают на ЭВМ программу «ads1.exe» и выполняют работу в соответствии с указаниями, которые появляются на экране монитора.
5. Результаты работы.
C экрана монитора записывают таблицу величин Р, а, 1/Р и 1/а.
| Р, мм рт. ст. | а, г/г | 1/Р | 1/а |
На миллиметровой бумаге формата А4 по этим данным строят график зависимости 1/а – 1/Р, по этому графику определяют приближенные значения aпред и b (уравнение 4).
Записывают с экрана результаты точного расчета коэффициентов уравнения Лэнгмюра на ЭВМ методом наименьших квадратов по уравнению (4).
| А | В | aпред = 1/А | b = А/В |
Сравнивают эти коэффициенты с найденными ранее графическим методом приближенными величинами и оценивают их относительную погрешность.
Записывают уравнение Лэнгмюра с найденными на ЭВМ коэффициентами (уравнение 3).
По уравнению (5) определяют удельную поверхность адсорбента. При этом величина aпред в этом уравнении должна быть выражена в единицах моль/г, а величина sуд должна быть получена в единицах м2/г.
6. Заключение (выводы).
В результате выполнения работы установлены основные закономерности процессов адсорбции газа на твердой поверхности:
- при постоянной температуре адсорбция газа возрастает с увеличением его парциального давления, построена изотерма адсорбции в координатах a – P;
- при постоянном давлении адсорбция с увеличением температуры уменьшается, а при постоянной адсорбции давление адсорбата быстро возрастает; исходя из общих принципов смещения равновесия нарисован общий вид изобары и изостеры адсорбции;
- освоены методы обработки экспериментальных данных по адсорбции – вручную и на ЭВМ;
- определены коэффициенты изотермы адсорбции Лэнгмюра, рассчитана удельная поверхность адсорбента sуд.
7. Индивидуальное задание по теме: Задание 7.4 [3].
8. Список литературы:
1) Общие требования и правила оформления текстовых документов: СТП СМК 4,2,3-01-2011. – Могилев: МГУП, 2011.
2) Методические указания для выполнения лабораторных работ на ЭВМ: «Кинетика химических реакций. Адсорбция». Для студентов технологических, химико-технологических и химических специальностей вузов / Могилевский государственный университет продовольствия; О.Г. Поляченок, Л.Д. Поляченок. – Могилев, 2005. – 40 с.
3) Поляченок, О.Г. Физическая и коллоидная химия. Практикум: Учебное пособие / О.Г. Поляченок, Л.Д. Поляченок. – Минск: Лаб. полиграфии УО БГТУ, 2006. – 380 с. – С.268–295.
4) Поляченок, О.Г. Физическая и коллоидная химия. Конспект лекций: / О.Г.
Поляченок, Л.Д. Поляченок. – Могилев: МГУП, 2008. – 196 с. – С. 153–160.