Лабораторная работа № 3.2
ИЗУЧЕНИЕ СПЕКТРА ВОДСРОДА И ОПРЕДЕЛЕНИЕ ПОСТОЯННОЙ РИДБЕРГА
Цель работы: ознакомление с устройством, работой и градуировкой призменного спектроскопа; изучение спектра водорода и определение постоянной Ридберга.
Оборудование: спектроскоп, неоновая и водородная лампы.
Теоретические сведения
Линейчатые спектры, присущие атомам разреженных газов в простейшем случае (для атоме водорода и водородоподобных систем) хорошо объясняются полуклассической теорией Бора, основанной на трех постулатах.
1й- постулат -: существуют стационарные состояния атомов, находясь в которых атом не излучает энергии. Стационарным состояниям соответствует движение электрона по определенным стационарным орбитам. Находясь на ней, электрон, несмотря на наличие ускорения, не излучает энергии.
2й- постулат -: при переходе атома из, одного стационарного состояния в другое атом излучает (или поглощает) квант энергии. Величина кванта энергии равна разности энергий, соответствующих тем стационарным состояниям, между которыми совершается переход:
 (1)
(1)
где n - частота излучения, h - постоянная Планка, En и Em - энергия атома в стационарных состояниях, между которыми совершается переход;. Если En>Em - атом излучает квант энергии; если En<Em - атом поглощает квант энергии.
3й – постулат –: электрон в атоме движется по таким (стационарным) круговым орбитам, для которых момент импульса электрона  кратен величине
кратен величине 
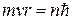 (2)
(2)
где m - масса электрона, v - его скорость, r - радиус круговой стационарной орбиты, n = 1, 2, 3. целое число.
Стационарное состояние, таким образом, характеризуется дискретными (квантованными) значениями энергии Еn и момента импульса Ln. Согласно теории Бора для атома водорода:
 (3)
(3)
где e - заряд электроне.
Тогда частоты спектральных линии атома водорода при переходе с орбиты с энергией Еn2 на орбиту с энергией: En1 будут следующие:
 (4)
(4)
Величина  называется постоянной Ридберга для атома водорода. Тогда:
называется постоянной Ридберга для атома водорода. Тогда:
 (5)
(5)
|где n1. - номер, стационарного состояния (т.е. энергетического уровня), на который совершается переход, n2, - с которого совершается переход.
При переходе электронов в атоме водорода на орбиту с наименьшей энергией (n 1 = 1) излучается серия линий, лежащих в ультрафиолетовой части спектра (серия Ланмана). При -переходе на орбиту с n1 = 2 излучаются линии серии Бальмера, четыре линяй которой лежат в видимой части спектра.
На рис. 1 числа у коротких стрелок указывают наибольшую длину волны в Å данной серия. По оси указаны значения энергии в электронвольтах.
Следует заметить, что по современным представлениям нельзя говорить об орбитах как о траекториях истинного движения электронов. Движение; электрона описывается с учетом его волновых свойств уравнением Шредингера.
Однако представление о стационарных уровнях энергии атома остается в силе на основе более точной квантовой теории.

Рис. 1. Схема энергетических, уровней и излучательных переходов для атома водорода
Методика проведения эксперимента
Зная, что  получим, что
получим, что  . Зная теоретическое значение RН по спектру излучения атома водорода можно найти длины волн соответствующие серии Бальмера (n1 = 2, n2 = 3, 4, 5 т.д.). Т. е. такие линии для которых n2 наиболее близкое к значениям целых чисел: 3, 4, 5и т.д.
. Зная теоретическое значение RН по спектру излучения атома водорода можно найти длины волн соответствующие серии Бальмера (n1 = 2, n2 = 3, 4, 5 т.д.). Т. е. такие линии для которых n2 наиболее близкое к значениям целых чисел: 3, 4, 5и т.д.
Определив длины вол, видимой серии Бальмера с их помощью можно экспериментально определить значение постоянной Ридберга; по формуле
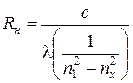
nx = 3, 4, 5
Определить 
Контрольные вопросы
А) Для допуска к работе
1. Сформулировать постулаты Бора.
2. Как зависит энергия стационарного состояния от квантового числа? Вывести формулу.
3. Как образуется спектр излучения атома водорода и серия Бальмера?
4. Привести и пояснить формулу Бальмера.
5. Какова методика определения постоянной Ридберга в данной работе?
6. Объяснить устройство и принцип работы спектроскопа.
Б) Для сдачи работы
1. Проанализировать результат определения Rн.
2. Почему различные серии линий атома водорода лежат в различных областях спектра и в каких именно?
3. Объяснить сериальные закономерности в.спектре атома водорода.
Литература
1. Ландсберг Г. С. Оптика. - М;.: Высшая школа, 1976.
2. Физический практикум/Под.ред. В. И. Ивероновой. -. М.: Наука, 1968.