Окислительная способность природных вод, характеризующая их активность ОВР, называется редокс-реакцией. Большинство наиболее важных редокс-реакций катализируется микроорганизмами. Инициирование процессов окисления, протекающих в природных водах, в большинстве случаев, связано с присутствием в природных водах таких окислителей, как свободные радикалы, пероксид водорода, озон, и некоторых других сильных окислителей.
Окисленные формы + nē ↔ восстановленные формы
Под активностью электронов понимается способность системы поставлять электроны для окислительно-восстановительного процесса. Направление окислительно-восстановительных реакций в природных водах зависит от рН.Активность воды представляется через редокс-потенциал. Он аналогичен значению pH, но характеризует не кол-во ионов водорода, а потенциальную возможность природной воды к участию в ОВР.
pe=-lg(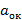 )
)
Энергия Гиббса в ходе ОВР принимает =0. Потенциал, измеряемый по отношению к стандартному водородному электроду, называется стандартным электродным потенциалом Eh. И от того, какое значение (+ или -) имеет данная величина, будет зависеть ОВ активность в растворе.
Величина ОВ потенциала, протекающая с участием ионов водорода, зависит от pH раствора.
Н2О= О2 +  + ē
+ ē
Н2О + ē= 
Природная вода обычно находится в контакте с О2, в котор. парциал. давлен. молекул кислорода и водорода меньше 1 атмосферы. Поэтому их ОВ потенциалы будут определяться значениями:
pē = 20,78 – pH
pe=-pH.
Под редокс-буферностью понимают способность системы сохранять постоянное значение редокс-уровня за счет присутствия соединений, способных окисляться или восстанавливаться при поступлении в систему небольших количеств окислителей или восстановителей
Восстановление кислорода происходит в две стадии:
О2 + 2Н+ + 2ē = Н2О2
Н2 О2+ē =  +H2O
+H2O
Если на окисл.проц. израсходован весь кислород, а в систему продолжают поступать орган.в-ва, то ОВР будет идти за счет других соединений.
Денитрификация. Роль реакции состоит в превращении нитрата (важного компонента питания) в биологически инертный молекулярный азот. При этом бактерии используют для окисления органического вещества до СО2 кислород нитратных ионов:
2,5Cоpr + 2  + 2H+ = N2 + 2,5CO2 + Н2О (94)
+ 2H+ = N2 + 2,5CO2 + Н2О (94)
В процессе динитрификации помимо азота могут образоваться гемиоксид, оксид и диоксид азота, которые играют важную роль в процессах, протекающих в тропосфере (оксид и диоксид азота) и стратосфере (гемиоксид азота).
Восстановление сульфатов, или сульфат-редукция. Это реаrции, в которых бактерии используют для окисления органического вещества кислород сульфатных ионов, образуя в качестве продуктов жизнедеятельности сульфидные формы:
2Cоpr +  + 2H2O=H2S + 2
+ 2H2O=H2S + 2  (94)
(94)
Если рН воды выше 7, образуется главным образом ион HS–, а в присутствии любых способных к реакциям соединений железа сульфидные формы будут реагировать с ними, образуя осадки в виде сульфидов.
Ферментация. Реакции ферментации представляют собой протекающие при участии микроорганизмов процессы разрушения органических веществ с образованием новых более простых органических соединений.
[Органическое соединение А] → [органическое соединение В] + СО2.
Самой простой и одной из наиболее важных реакций этого типа является реакция образования метана
Сорг + 2Н2 О → СО2 + СН4
Процессы ферментации протекают при значениях р менее 4 – 5 вплоть до границы устойчивости воды.
