Лекция № 1. Строение атома
Структура лекции:
§ 1.1. Опыт Резерфорда. Ядерная модель атома.
§ 1.2. Квантовые постулаты Бора.
§ 1.3. Атом водорода. Линейчатые спектры.
§ 1.4. Лазеры.
Атом водорода. Линейчатые спектры
План:
1. Теория Бора для атома водорода.
2. Спектральные линии и энергетические уровни атома водорода.
Простейший из атомов, атом водорода явился своеобразным тест-объектом для теории Бора. Ко времени создания теории он был хорошо изучен экспериментально. Было известно, что он содержит единственный электрон. Ядром атома является протон – положительно заряженная частица, заряд которой равен по модулю заряду электрона, а масса в 1836 раз превышает массу электрона. Еще в начале XIX в. были открыты дискретные спектральные линии в видимой области излучения атома водорода (так называемый линейчатый спектр). Впоследствии закономерности, которым подчиняются длины волн (или частоты) линейчатого спектра, были хорошо изучены количественно (И. Бальмер, 1885 г.). Совокупность спектральных линий атома водорода в видимой части спектра была названа серией Бальмера. Позже аналогичные серии спектральных линий были обнаружены в ультрафиолетовой и инфракрасной частях спектра. В 1890 г. Й. Ридберг[1] получил эмпирическую формулу для частот спектральных линий:
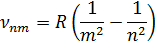
где 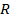 – постоянная Ридберга (
– постоянная Ридберга (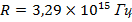 )
)
Для серии Бальмера 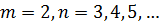 . Для ультрафиолетовой серии (серия Лаймана)
. Для ультрафиолетовой серии (серия Лаймана) 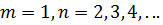 .
.
Правило квантования, приводящее к согласующимся с опытом значениям энергий стационарных состояний атома водорода, Бором было угадано. Он предположил, что момент импульса электрона, вращающегося вокруг ядра, может принимать только дискретные значения, кратные постоянной Планка. Для круговых орбит правило квантования Бора записывается в виде:
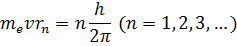
где 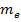 – масса электрона,
– масса электрона, 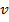 – его скорость,
– его скорость, 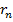 – радиус стационарной круговой орбиты.
– радиус стационарной круговой орбиты.
Правило квантования Бора позволяет вычислить радиусы стационарных орбит электрона в атоме водорода и определить значения энергий. Скорость электрона, вращающегося по круговой орбите некоторого радиуса 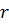 в кулоновском поле ядра, как следует из второго закона Ньютона, определяется соотношением:
в кулоновском поле ядра, как следует из второго закона Ньютона, определяется соотношением:
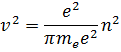
где 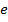 – элементарный заряд,
– элементарный заряд, 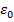 – электрическая постоянная.
– электрическая постоянная.
Скорость электрона 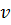 и радиус стационарной орбиты
и радиус стационарной орбиты 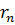 связаны правилом квантования Бора. Радиусы стационарных круговых орбит определяются выражением:
связаны правилом квантования Бора. Радиусы стационарных круговых орбит определяются выражением:
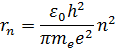
Самой близкой к ядру орбите соответствует значение 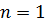 . Радиус первой орбиты, который называется боровским радиусом, равен:
. Радиус первой орбиты, который называется боровским радиусом, равен:
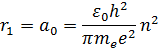
Радиусы последующих орбит возрастают пропорционально n2.
Полная механическая энергия E системы из атомного ядра и электрона, обращающегося по стационарной круговой орбите радиусом 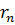 , равна:
, равна:
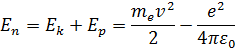
Следует что 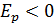 , так как между электроном и ядром действуют силы притяжения. Подставляя в формулу выражения для
, так как между электроном и ядром действуют силы притяжения. Подставляя в формулу выражения для 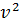 и
и 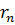 :
:
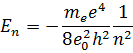
где целое число 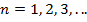 называется в квантовой физике атома главным квантовым числом.
называется в квантовой физике атома главным квантовым числом.
Согласно второму постулату Бора, при переходе электрона с одной стационарной орбиты с энергией 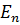 на другую стационарную орбиту с энергией
на другую стационарную орбиту с энергией 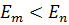 атом испускает квант света, частота
атом испускает квант света, частота 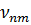 которого равна
которого равна 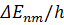 :
:
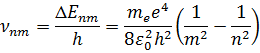
Формула в точности совпадает с эмпирической формулой Ридберга для спектральных серий атома водорода, если положить постоянную 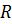 равной:
равной:
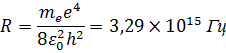
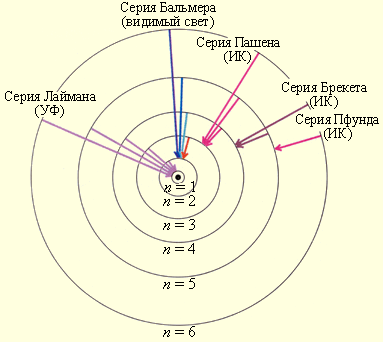
|
| Рис. 1.3.1. Стационарные орбиты атома водорода.. |
На рис. 1.3.2. изображена диаграмма энергетических уровней атома водорода и переходы, соответствующие различным спектральным сериям.
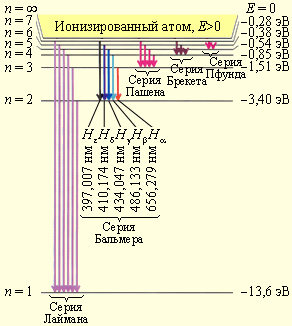
|
| Рис. 1.3.2. Диаграмма энергетических уровней атома водорода. |
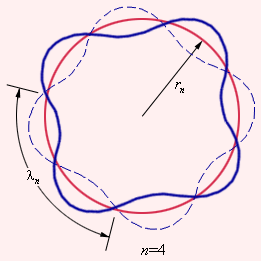
Боровская теория атома подходит только для атома водорода. Бор не смог дать физическую интерпретацию правилу квантования. Позже де Бройлем на основе представлений о волновых свойствах частиц. Стационарная орбита возникает в том случае, когда волна непрерывно повторяет себя после каждого оборота вокруг ядра. Другими словами, стационарная орбита соответствует круговой стоячей волне де Бройля на длине орбиты (рис. 1.3.3). Это явление очень похоже на стационарную картину стоячих волн в струне с закрепленными концами.
В стационарном квантовом состоянии атома водорода на длине орбиты должно укладываться по идее де Бройля целое число длин волн 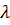 , т.е:
, т.е:
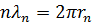
Соотношение длину волны де Бройля 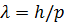 , где
, где 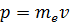 – импульс электрона, получим:
– импульс электрона, получим:
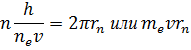
Боровское правило квантования связано с волновыми свойствами электронов.
|
| Рис. 1.3.3. Иллюстрация идеи де Бройля возникновения стоячих волн на стационарной орбите. |
Атомы – квантовые системы, а энергетические уровни стационарных состояний атомов дискретны.
Дискретность энергетических состояний атома была продемонстрирована в 1913 г., в опыте Д. Франка и Г. Герца, в котором исследовалось столкновение электронов с атомами ртути. Оказалось, что если энергия электронов меньше 4,9 эВ, то их столкновение с атомами ртути происходит по закону абсолютно упругого удара. Если же энергия электронов равна 4,9 эВ, то столкновение с атомами ртути приобретает характер неупругого удара, т.е. в результате столкновения с неподвижными атомами ртути электроны полностью теряют свою кинетическую энергию. Это означает, то атомы ртути поглощают энергию электрона и переходят из основного состояния в первое возбужденное состояние: 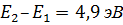 .
.
Согласно боровской концепции, при обратном самопроизвольном переходе атома ртуть должна испускать кванты с частотой:
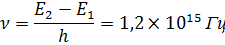
Спектральная линия с такой частотой действительно была обнаружена в ультрафиолетовой части спектра излучения атомов ртути.
Представление о дискретных состояниях противоречит классической физике.
Квантовая физика не отменила фундаментальных классических законов сохранения энергии, импульса, электрического разряда и т.д. Согласно сформулированному Н. Бором принципу соответствия, квантовая физика включает в себя законы классической физики, и при определенных условиях можно обнаружить плавный переход от квантовых представлений к классическим. Это можно видеть на примере энергетического спектра атома водорода (рис. 1.3.2). При больших квантовых числах 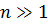 дискретные уровни постепенно сближаются, и возникает плавный переход в область непрерывного спектра, вытекающего из классической физики.
дискретные уровни постепенно сближаются, и возникает плавный переход в область непрерывного спектра, вытекающего из классической физики.
Физический смысл имеет только вероятность обнаружить электрон в том или ином месте, описываемая квадратом модуля волновой функции 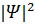 . Волновая функция
. Волновая функция 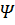 является решением основного уравнения квантовой механики – уравнения Шредингера. Оказалось, что состояние электрона в атоме характеризуется целым набором квантовых чисел. Главное квантовое число
является решением основного уравнения квантовой механики – уравнения Шредингера. Оказалось, что состояние электрона в атоме характеризуется целым набором квантовых чисел. Главное квантовое число 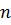 определяет квантование энергии атома. Для квантования момента импульса вводится так называемое орбитальное квантовое число
определяет квантование энергии атома. Для квантования момента импульса вводится так называемое орбитальное квантовое число 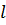 . Проекция момента импульса на любое выделенное в пространстве направление (например, направление вектора
. Проекция момента импульса на любое выделенное в пространстве направление (например, направление вектора 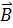 магнитного поля) также принимает дискретный ряд значений. Для квантования проекции момента импульса вводится магнитное квантовое число m. Квантовые числа
магнитного поля) также принимает дискретный ряд значений. Для квантования проекции момента импульса вводится магнитное квантовое число m. Квантовые числа 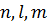 связаны определенными правилами квантования. Например, орбитальное квантовое число
связаны определенными правилами квантования. Например, орбитальное квантовое число 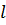 может принимать целочисленные значения от 0 до (
может принимать целочисленные значения от 0 до (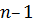 ). Магнитное квантовое число
). Магнитное квантовое число 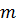 может принимать любые целочисленные значения в интервале
может принимать любые целочисленные значения в интервале 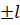 . Таким образом, каждому значению главного квантового числа
. Таким образом, каждому значению главного квантового числа 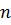 , определяющему энергетическое состояние атома, соответствует целый ряд комбинаций квантовых чисел
, определяющему энергетическое состояние атома, соответствует целый ряд комбинаций квантовых чисел 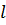 и
и 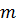 . Каждой такой комбинации соответствует определенное распределение вероятности
. Каждой такой комбинации соответствует определенное распределение вероятности 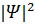 обнаружения электрона в различных точках пространства («электронное облако»).
обнаружения электрона в различных точках пространства («электронное облако»).
Состояния, в которых орбитальное квантовое число 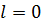 , описываются сферически симметричными распределениями вероятности. Они называются s-состояниями (
, описываются сферически симметричными распределениями вероятности. Они называются s-состояниями (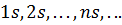 ). При значениях
). При значениях 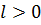 сферическая симметрия электронного облака нарушается. Состояния с
сферическая симметрия электронного облака нарушается. Состояния с 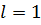 называются -состояниями, с
называются -состояниями, с 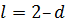 -состояниями и т.д.
-состояниями и т.д.
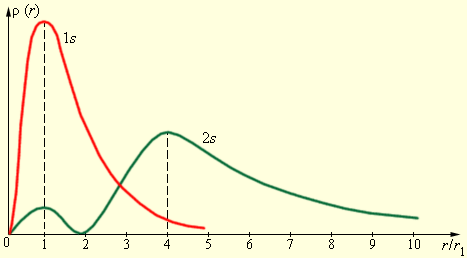
На рис. 1.3.4 изображены кривые распределения вероятности 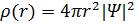 обнаружения электрона в атоме водорода на различных расстояниях от ядра в состояниях
обнаружения электрона в атоме водорода на различных расстояниях от ядра в состояниях 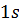 и
и 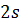 .
.
|
| Рис. 1.3.4. Распределение вероятности обнаружения электрона в атоме водорода. |
Как видно из рис. 1.3.4, электрон в состоянии 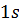 (основное состояние атома водорода) может быть обнаружен на различных расстояниях от ядра. С наибольшей вероятностью его можно обнаружить на расстоянии, равном радиусу
(основное состояние атома водорода) может быть обнаружен на различных расстояниях от ядра. С наибольшей вероятностью его можно обнаружить на расстоянии, равном радиусу 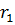 первой боровской орбиты. Вероятность обнаружения электрона в состоянии
первой боровской орбиты. Вероятность обнаружения электрона в состоянии 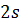 максимальна на расстоянии
максимальна на расстоянии 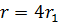 от ядра. В обоих случаях атом водорода можно представить в виде сферически симметричного электронного облака, в центре которого находится ядро.
от ядра. В обоих случаях атом водорода можно представить в виде сферически симметричного электронного облака, в центре которого находится ядро.
[1] Йоханнес Роберт Ридберг (1854 – 1919) – шведский физик. Занимался изучением периодической системы элементов и атомных спектров.