МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА
РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЖЕВСКАЯ ГОСУДАРСТВЕННАЯ СЕЛЬСКОХОЗЯЙСТВЕННАЯ АКАДЕМИЯ
КАФЕДРА “ПРОЦЕССЫИ АППАРАТЫ”
УТВЕРЖДАЮ:
Проректор по учебной работе
доцент __________ А. И. Любимов
“_____”_____________ 1998 г.
Основы массопередачи. Абсорбция. Ректификация
Методическое руководство к решению примеров и задач по курсу “Процессы и аппараты”
Ижевск -1998 г.
Составитель:
Иванов В. И. - к. т. н., заведующий кафедрой “Процессы и аппараты.” ИжГСХА.
Рецензент:
Касаткин В. В. - Заведующий кафедрой “Механизация переработки сельскохозяйственной прдукции.”
Ответственный за выпуск - заведующий кафедрой “Процессы и аппараты” к. т. н., доцент Иванов В. И.
Одобрено и рекомендовано к изданию методической комиссией факультета механизации сельского хозяйства ИжГСХА.
(протокол №______от”____”________199__г.)
_______________________________________
Зак. Тир. п. л. ИжГСХА 199__г.
СОДЕРЖАНИЕ
Глава 1. Основы массопередачи. Абсорбция.
Основные зависимости и расчетные формулы 2
Примеры 21
Глава 2. Перегонка и ректификация.
Основные зависимости и расчетные формулы 50
Примеры 59
Глава 1.
Основы массопередачи. Абсорбция
Основные зависимости и расчетные формулы
1. Способы выражения состава фаз двухкомпонентных систем жидкость-газ (пар) представлены в табл. 1.1.
Формулы для пересчета концентраций (в жидкой фазе) даны в табл.1.2. Для газовой (паровой) фазы справедливы те же соотношения, но с заменой обозначений x на y, X на Y, С X на С y
2. Концентрация компонента в газовой фазе может быть выражена так же через его парциальное давление. На основании уравнений Клайперона и Дальтона мольная (объемная) доля у любого компонента смеси идеальных газов равняется:
y=р/П, (1.1)
где р-парциальное давление компонента газовой смеси; П=рА+рВ+рС+...-общее давление смеси газов или паров, равное сумме парциальных давлений всех компонентов.
3. Законы межфазного равновесия для идеальных растворов.
а) Закон Генри:
р*=Еx, (1.2)
где р*-парциальное давление компонента в газовой фазе; над равновесной с газом жидкостью; x-мольная доля компонента в жидкости; Е-коэффициент Генри, зависящий от температуры и от природы газа и жидкости.
Значения Е для водных растворов некоторых газов даны в табл.XLI.
Подставляя в уравнение (1.2) значение р*=y*П по уравнению (1.1), получаем:
y*=mx. (1.3)
Т а б л и ц а 1.1.
| Концентрация | Обозначение концентрации компонента А | |
| в жидкой фазе | в газовой или паровой фазе | |
Мольная доля, 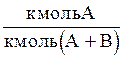
| x | y |
Массовая доля 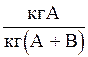
| `x | `y |
Относительная мольная концентрация (доля), 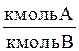
| X | Y |
Относительная массовая концентрация (доля), 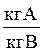
| `X | `Y |
Объемная мольная концентрация, 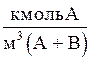
| СX | Сy |
Объемная массовая концентрация, 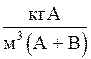
| `СX | `Сy |
Здесь y*-мольная доля компонента в газовой фазе, равновесной с жидкостью; m=Е/П-безразмерный коэффициент (коэффициент распределения), постоянный для данной системы газ-жидкость при t=const и П=const
Если применительно к двухфазной трехкомпонентной системе (газовая фаза: А+В, жидкая фаза А+С), подставить в уравнение равновесия (1.3) значения x и y* (для компонента А, выраженные через его относительные концентрации X и Y*, `X и `Y* (табл. 1.2), получим:
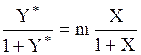 ; (1.4)
; (1.4)
Т а б л и ц а 1.2
| Выражение концентрации компонента А | x | `x | X | `X | Cx | `Cx |
| x | - | 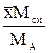 или
или
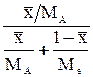
|
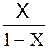
|
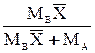
| 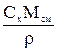 или
или
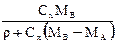
| 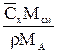 или
или
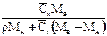
|
| `x | 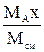
| - | 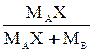
| 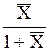
| 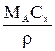
| 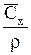
|
| X | 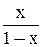
| 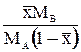
| - | 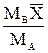
| 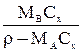
| 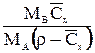
|
| `X | 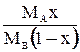
| 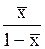
| 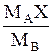
| - | 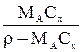
| 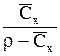
|
| Cx | 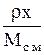
| 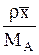
| 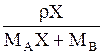
| 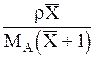
| - | 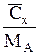
|
| `Cx | 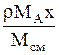
| r`x | 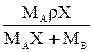
| 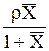
| МАСx | - |
МА, МВ, Мсм-мольные массы компонентов и смеси, кг/кмоль; Мсм= МАx+ МВ(1-x); r-плотность смеси, кг/м3. Для смеси идеальных газов: 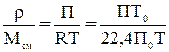 .
.
 |
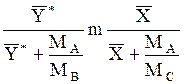 , (1.5)
, (1.5)
где МА- мольная масса распределенного между фазами компонента А; МВ-то же второго компонента бинарной газовой смеси; МС-то же второго компонента бинарной жидкой смеси.
При малых концентрациях распределенного компонента в газе и в жидкости, когда Y*<< 1 и X << 1, в знаменателях уравнения (1.4) величинами Y* и X можно пренебречь, и оно получает вид:
Y* =mX. (1.6)
Аналогично при `Y*<< 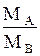 и `X <<
и `X << 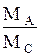 из уравнения (1.5) получим:
из уравнения (1.5) получим:
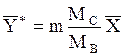 (1.6а)
(1.6а)
б) закон Рауля:
р*=Рx, (1.7)
где р*-парциальное давление компонента в парогазовой смеси над жидкостью в условиях равновесия; Р-давление насыщенного пара чистого компонента- однозначная функция температуры; Р= f(t); x-мольная доля компонента в жидкости.
При подстановке в уравнение (1.7) значенияр*=y*П из уравнения (1.1) получаем:
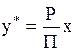 , (1.8)
, (1.8)
где y*-мольная доля компонента в парогазовой фазе, равновесной с жидкостью.
Для двухкомпонентной смеси, когда оба ее компонента следуют закону Рауля, уравнение (1.8) приводится к виду:
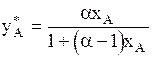 . (1.9)
. (1.9)
Здесь a=РА/РВ-коэффициент относительной летучести; РА-давление насыщенного пара более летучего (низкокипящего) компонента при той же температуре; РВ- давление насыщенного пара менее летучего (высококипящего) компонента при той же температуре.
4. Многочисленные экспериментальные данные о равновесных составах жидкости и пара для различных растворов имеются в справочнике*. Для некоторых бинарных смесей данные о равновесных составах жидкости и пара при П=const приведены в табл. XLVII и на рис. XXI и XXII.
5. Причиной (движущей силой) процесса массопередачи-перехода какого-либо компонента из одной фазы в другую (например, из жидкой фазы Фx с мольной концентрацией переходящего компонента x в газовую фазу Фy с мольной концентрацией y) является неравновесность соприкасающихся фаз, их отклонение от состояния динамического равновесия. В химической термодинамике устанавливается, что величина этого отклонения, при равенстве температур и давлений фаз, определяется разностью химических потенциалов переходящего компонента (mx-my), которая и является движущей силой процесса массопередачи. При равновесии фаз потенциалы mx и my ðàâíû.
Заменяя потенциал mx равным ему потенциалом равновесной газовой смеси 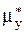 , получим для движущей силы процесса массопередачи выражение
, получим для движущей силы процесса массопередачи выражение
mx-my= 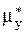 -my.
-my.
Аналогично, заменяя потенциал my равным ему потенциалом равновесной жидкой фазы 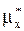 , получим:
, получим:
mx-my=mx- 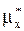 .
.
Из последних равенств следует, что движущая сила процесса (mx-my) может быть выражена двумя способами: либо как разность химических потенциалов, взятых по газовой фазе, либо как разность потенциалов, взятых по жидкой фазе. При этом необходимо помнить, что газовая фаза с потенциалом 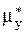 и концентрацией y*, так же как и жидкая фаза с потенциалом
и концентрацией y*, так же как и жидкая фаза с потенциалом 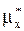 и концентрацией x*,-фазы гипотетические, в реальном процессе массопередачи отсутствующие - см. рис. 1.1.
и концентрацией x*,-фазы гипотетические, в реальном процессе массопередачи отсутствующие - см. рис. 1.1.
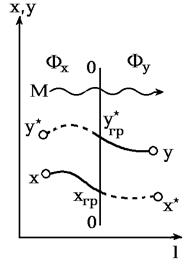
Рис 1.1.Схема процесса массопередачи:
00-граница раздела фаз.
В технических расчетах применяют не химические потенциалы, а более простые, легко определяемые величины-концентрации, с помощью которых также может быть охарактеризовано отклонение фаз Фx и Фy от состояния равновесия. Однако, в отличие от разности химических потенциалов (mx-my), которая равна нулю при равновесии фаз, разность концентраций (x-y), в общем случае не равная нулю при равновесии*, не может служить мерой отклонения фаз от равновесного состояния, т. е. движущей силой процесса массопередачи. При технических расчетах движущую силу процесса массопередачи-отклонение системы от состояния равновесия-выражают поэтому как разность концентраций (y*-y) или (x-x*). Так как концентрации могут быть выражены в различных единицах, то движущая сила процесса массопередачи может иметь различные значения-см. пример 1.3.
6. В соответствии с двумя возможными способами выражения движущей силы процесса массопередачи по газовой фазе (Dy=y*-y) или по жидкой фазе (Dx=x-x*)-уравнение массопередачи, аналогичное уравнению теплопередачи, может быть написано в двух видах:
М=КyDyсрF (1.10)
или
М=КxDxсрF (1.11)
Здесь М-расход компонента, переходящего из одной фазы в другую, кмоль/с; F-площадь поверхности массопередачи, м2; Кy-коэффициент массопередачи, отнесенный к движущей силе Dy, выраженной через мольные доли компонента в газовой фазе, кмоль/(м2×с)**; Кx - коэффициент массопередачи, отнесенный к движущей силе Dx выраженной через мольные доли компонента в жидкой фазе, кмоль/(м2×с); Dxср и Dyср-соответствующие средние для всего процесса движущие силы (см. ниже).
В последних уравнениях вместо мольных расходов и концентраций могут быть массовые, а вместо Dyср могут быть DYср; DСyср и Dрср; соответственно вместо Dxср могут быть DXср или DСxср.
7. При определенных допущениях (отсутствие диффузионного сопротивления при переходе компонента через поверхность раздела фаз, существование равновесия на этой поверхности, линейность уравнения равновесия y*=mx или y*=mx+b) получаются следующие зависимости между коэффициентами массопередачи Кy и Кx и фазовыми коэффициентами массопередачи by и bx :
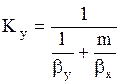 ; (1.12)
; (1.12)
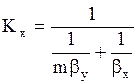 , (1.13)
, (1.13)
где m-тангенс угла наклона линии равновесия. Коэффициенты массоотдачи и массопередачи выражены в кмоль/(м2×с).
Знаменатели последних уравнений представляют собой общее диффузионное сопротивление, равное сумме диффузионных сопротивлений газовой и жидкой фаз.
Когда основное диффузионное сопротивление сосредоточено в газовой фазе, т. е. при 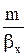 <<
<< 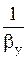 ,
,
Кy » by . (1.14)
Когда основное диффузионное сопротивление сосредоточено в жидкой фазе, т. е. при 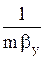 <<
<< 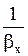 ,
,
Кx » bx . (1.15)
Из уравнений (1.12) и (1.13) следует, что
Кy =Кx/m (1.16)
8. Основные диффузионные критерии подобия установившихся процессов массоотдачи.
Диффузионный критерий Нуссельта:
Nu¢=bl/D. (1.17)
Диффузионный критерий Пекле:
Pe¢=wl/D. (1.18)
Диффузионный критерий Прандтля:
Pr¢= Pe¢/Re=n/D. (1.19)
Здесь b - коэффициент массоотдачи, м/с 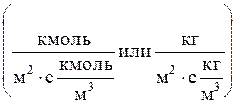 ;
;
l-характерный линейный размер, м; D-коэффициент молекулярной диффузии, м2/с; w-скорость газа или жидкости, м/с; n-кинематический коэффициент вязкости, м2/с.
Та б л и ц а 1.3.
| Атомный объем, см3/атом | Мольный объем, см3/моль |
| В 27,0 С 14,8 Cl 24,6 H 3,7 N в первичных аминах 10,5 N во вторичных аминах 12,0 N с двумя насыщенными связями 15,6 О с двумя насыщенными связями 7,4 О в альдегидах и кетонах 7,4 О в сложных эфирах 9,1 О в простых эфирах 9,9 О в высших простых и сложных эфирах 11,0 О в кислотах 12,0 О в соединениях с S, P, N 8,3 S 25,6 | I 37,0 H2 14,3 O2 25,6 N2 31,2 Воздух 29,9 CO 30,7 CO2 34,0 SO2 44,8 NO 23,6 NO2 36,4 NH3 25,8 H2O 18,9 H2S 32,9 COS 51,5 Cl2 48,4 Br2 53,2 I2 71,5 |
Cтруктурные постоянные*
Бензольное кольцо -15
Нафталиновое кольцо -30
Антраценовое кольцо -47,5
9. При отсутствии экспериментальных данных коэффициент диффузии (молекулярной) газа А в газе В (или газа В в газе А) может быть вычислен по формуле:
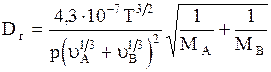 , (1.20)
, (1.20)
где Dг-коэффициент диффузии, м2/с; Т-температура, К; р-давление (абсолютное), кгс/см2; МА и МВ-мольные массы газов А и В; uА и uВ -мольные объемы газов А и В, определяемые как сумма атомных объемов элементов, входящих в состав газа- см. пример 1.6 (атомные объемы некоторых элементов и мольные объемы некоторых газов приведены в табл. 1.3).
Как следует из формулы (1.20), если известно значение коэффициента диффузии D1 при температуре Т1 и давлении р1, то значение его D2 при температуре Т2 и давлении р2 можно найти из уравнения:
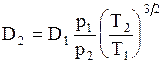 . (1.21)
. (1.21)
Значения коэффициентов диффузии в воздухе для некоторых газов и паров приведены в табл. XLII.
10. Коэффициент диффузии в жидкости Dж при 20°С можно вычислить по приближенной формуле:
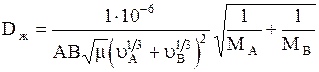 , (1.22)
, (1.22)
где Dж- коэффициент диффузии, м2/с; m-динамический коэффициент вязкости жидкости, мПа×с; uА и uВ -мольные объемы растворенного вещества и растворителя; МА и МВ- мольные массы растворенного вещества и растворителя; А и В -коэффициенты, зависящие от свойств растворенного вещества и растворителя.
Значения коэффициентов А для некоторых веществ, растворенных в воде:
Для газов 1
для этилового спирта 1,24
для метилового спирта 1,19
для уксусной кислоты 1,27
Коэффициент В равен:
Для воды 4,7
для этилового спирта 2,0
для метилового спирта 2,0
для ацетона 1,15
для неассоциированных жидкостей 1,0
Коэффициент диффузии газа в жидкости Dt (при температуре t) связан с коэффициентом диффузии D20 (при температуре 20°С) следующей приближенной зависимостью
Dt= D20[1+b(t-20)], (1.23)
в которой температурный коэффициент b может быть определен по эмпирической формуле:
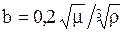 , (1.24)
, (1.24)
где m-динамический коэффициент вязкости жидкости при 20°С, мПа×с; r-плотность жидкости, кг/м3.
Значения коэффициентов диффузии некоторых газов в воде приведены в табл. XLIII.
Коэффициент диффузии в разбавленных растворах может быть вычислен также по формуле:
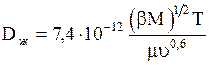 . (1.25)
. (1.25)
Здесь Dж- коэффициент диффузии, м2/с; М-мольная масса растворителя; u-мольный объем диффузирующего вещества; Т-температура, К; m-динамический коэффициент вязкости растворителя, мПа×с; b-параметр, учитывающий ассоциацию молекул растворителя и равный:
Для воды 2,6
для этилового спирта 1,5
для метилового спирта 1,9
для бензола, эфира, гептана 1
11. Материальный баланс абсорбера (рис. 1.2).
12.
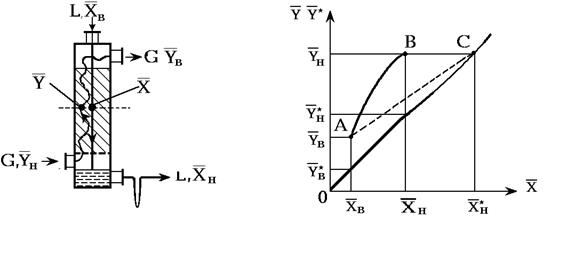
Рис. 1.2 Схема абсорбера.
Рис. 1.3 Рабочая и равновесная линии абсорбера:
АВ - рабочая линия при расходе поглотителя L; АС - рабочая линия при расходе поглотителя Lмин; ОС - равновесная линия Y*=f(`X).
При расчете абсорбера с нелетучим жидким поглотителем массовые (или мольные) расходы поглотителя и инертного, нерастворяющегося в жидкости газа будут постоянными по высоте абсорбера. Выражая концентрации поглощаемого компонента в газе и жидкости в относительных массовых (или мольных) единицах, получим уравнение материального баланса (в массовых единицах):
М=G(Yн-`Yв)=L(Xн-`Xв), (1.26)
где М-расход поглощаемого компонента, кг/с; и L- расходы инертного газа и жидкого поглотителя, кг/с; `Yн и`Yв - концентрации поглощаемого компонента в газе в низу и на верху абсорбера, кг/кг инертного газа; `Xн и`Xв- то же в жидкости в низу и на верху абсорбера, кг/кг жидкого поглотителя.
В координатах `Y -`X уравнение (1.26), при постоянных G и L, выражает отрезок прямой, проходящей через точки В [`Yн,`Xн] и А [`Yв,`Xв] - см. рис. 1.3.
Уравнение этой прямой- рабочей линии:
`Y=`Yн+ 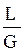 (`X-`Xн) (1.27)
(`X-`Xн) (1.27)
или
`Y=`Yв+ 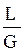 (`X-`Xв) (1.28)
(`X-`Xв) (1.28)
где`Y и`X-переменные по высоте колонны концентрации поглощаемого компонента в контактирующих неравновесных потоках газа и жидкости в данном сечении абсорбера - рис. 1.2.
Расход жидкого поглотителя:
L=jLмин. (1.29)
Здесь j>1-коэффициент избытка поглотителя; Lмин-теоретически минимальный расход поглотителя, определяемый графическим (см. рис. 1.3) или аналитическим путем:
Lмин= 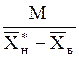 . (1.30)
. (1.30)
Степенью поглощения (или извлечения) называется величина
сП= 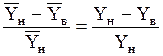 . (1.30а)
. (1.30а)
12. Средняя движущая сила в абсорбере с непрерывным контактом фаз.
В общем уравнении массопередачи
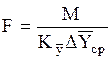 (1.31)
(1.31)
(где F - поверхность массопередачи в абсорбере, м2; М - расход поглощаемого компонента, кг/с; К`y - коэффициент массопередачи, 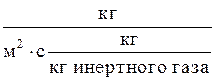 ) средняя движущая сила D`Yср определяется следующим образом.
) средняя движущая сила D`Yср определяется следующим образом.
Если в пределах от `Xв до`Xн (рис. 1.3) линия равновесия прямая, то
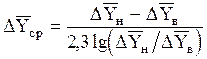 , (1.32)
, (1.32)
где D`Yн и D`Yв- концевые движущие силы; D`Yн =`Yн -`Yн* - в низу абсорбера при `X =`Xн; D`Yв =`Yв -`Yв*- на верху абсорбера при `X=`Xв.
Когда отношение D`Yн и D`Yв находятся в пределах
0,5 £ D`Yн / D`Yв £ 2,
среднюю движущую силу в абсорбере можно рассчитывать по более простой формуле:
D`Yср = (D`Yн+D`Yв)/2. (1.33)
Если же линия равновесия не прямая, то
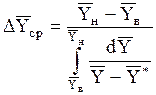 . (1.34)
. (1.34)
Величину интеграла в знаменателе последнего уравнения находят графическим построением или методом графического интегрирования. Другой метод расчета при криволинейной линии равновесия: разбивают равновесную линию на участки, принимаемые приближенно за отрезки прямых, и для каждого участка в отдельности определяют среднюю движущую силу по уравнению (1.32) или (1.33).
При расчетах абсорберов движущую силу часто выражают в единицах давления - см. пример 1.9.
13. Определение диаметра насадочного абсорбера.
Диаметр абсорбционной колонны D (в м) рассчитывают по уравнению расхода для газового потока:
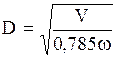 , (1.35)
, (1.35)
где V - расход газа, проходящего через абсорбер, м3/с; w - скорость газа, отнесенная к полному поперечному сечению колонны (фиктивная), м/с.
Скорость газа w находят следующим путем.
Сначала рассчитывают фиктивную скорость газа w3 в точке захлебывания (инверсии) по уравнению (при rж >> rг):
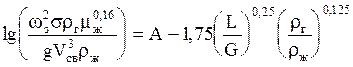 . (1.36)
. (1.36)
Здесь s-удельная поверхность насадки, м2/м3; g-ускорение свободного падения, м/с2; Vсв- свободный объем насадки, м3/м3; rг и rж- плотности газа и жидкости, кг/м3; mж-динамический коэффициент вязкости жидкости, мПа×с; L и G-массовые расходы жидкости и газа, кг/с; А=0,022 для насадки из колец или спиралей*, для ректификации А=-0,125.
Затем определяют рабочую скорость газа w (фиктивную), принимая для абсорберов, работающих в пленочном режиме
w=(0,75 ¸ 0,9) wз (1.37)
14. Определение высоты насадочного абсорбера.
а) Через высоту единицы переноса (ВЕП).
Поверхность контакта фаз в абсорбере при пленочном режиме работы:
F= НнSsy, (1.38)
где Нн- высота слоя насадки, м; S=pD2/4-площадь поперечного сечения колонны, м2; D-диаметр колонны, м; s-удельная поверхность сухой насадки, м2/м3; y-коэффициент смоченности насадки, безразмерный - расчет величины этого коэффициента см.*
Высота слоя насадки:
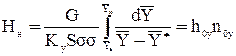 (1.39)
(1.39)
Здесь G - постоянный по высоте колонны расход инертного газа, кг/с или кмоль/с; Кy - средний коэффициент массопередачи, 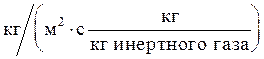 или
или 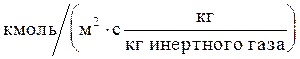 ; h0y-высота единицы переноса, м:
; h0y-высота единицы переноса, м:
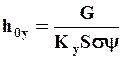 ; (1.40)
; (1.40)
n0y-общее число единиц переноса:
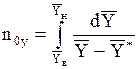 . (1.40а)
. (1.40а)
Из уравнения (1.34) следует:
n0y=(`Yн -`Yв)/ D`Yср. (1.41)
При прямолинейной равновесной зависимости среднюю движущую силу D`Yср рассчитывают по уравнению (1.32) или (1.33), при криволинейной равновесной зависимости число единиц переноса n0y находят графическим построением или методом графического интегрирования-см. пример 1.10.
Объемным коэффициентом массопередачи КyV называют величину
КyV= Кysy= Куа, (1.42)
где а=sj-удельная смоченная (активная) поверхность насадки, м2/м3; при y=1 а=s.
Применяя объемный коэффициент массопередачи, получаем для высоты единицы переноса:
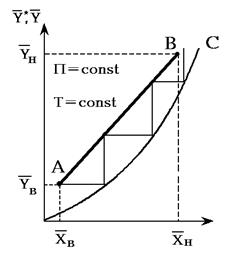
Рис.1.4. Графическое определение числа ступеней изменения концентрации (теоретических тарелок) в абсорбере
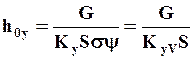 . (1.43)
. (1.43)
б) Через высоту, эквивалентную теоретической тарелке (ВЭТТ).
Высота слоя насадки Нн может быть рассчитана также по уравнению:
Нн=hэnт, (1.44)
где hэ - высота, эквивалентная теоретической тарелке (ВЭТТ) или теоретической ступени (ВЭТС), м (определяется по экспериментальным данным); nт - число теоретических тарелок (ступеней изменения концентрации).
Число теоретических тарелок-ступеней изменения концентрации в абсорбере определяют обычно графическим путем (рис. 1.4). На этом рисунке АВ - рабочая линия, построенная по уравнению (1.27) или (1.28), ОС - равновесная линия.
15. Критериальные формулы для расчета коэффициентов массоотдачи в насадочных абсорберах с неупорядоченной насадкой (навалом) при пленочном режиме.
а) Для газовой фазы:
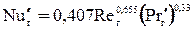 . (1.45)
. (1.45)
Здесь 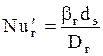 ;
; 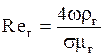 ;
; 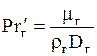 ; bг- коэффициент массоотдачи для газа,
; bг- коэффициент массоотдачи для газа, 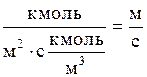 ; Dг- коэффициент диффузии поглощаемого компонента в газе, м2/с. Остальные обозначения - см. формулы (1.36) и (1.38).
; Dг- коэффициент диффузии поглощаемого компонента в газе, м2/с. Остальные обозначения - см. формулы (1.36) и (1.38).
Уравнение (1.45) справедливо при значениях Reг от 10 до 10 000.
б) Для жидкой фазы:
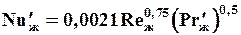 , (1.46)
, (1.46)
где 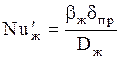 ;
; 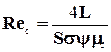 ;
; 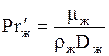 ; bж - коэффициент массоотдачи для жидкости, м/с;
; bж - коэффициент массоотдачи для жидкости, м/с; 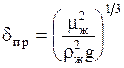 -так называемая приведенная толщина жидкой пленки, м; Dж- коэффициент диффузии поглощаемого компонента в жидкости, м2/с; L - массовый расход жидкости, кг/с.
-так называемая приведенная толщина жидкой пленки, м; Dж- коэффициент диффузии поглощаемого компонента в жидкости, м2/с; L - массовый расход жидкости, кг/с.
Выражение для критерия Reж получено следующим путем.
Обозначения-см. уравнения (1.36) и (1.38).
Омываемый жидкостью периметр сечения абсорбера находим из уравнения (1.38):
П=F/Нн=Ssy. (1.47)
Скорость течения пленки жидкости через насадку:
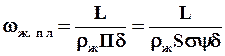 , (1.48)
, (1.48)
где d - средняя толщина пленки, м.
Эквивалентный диаметр жидкой пленки:
dпл=4Пd/П=4d. (1.49)
Подставляя эти значения в выражение для критерия Reж, получаем:
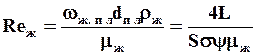 . (1.50)
. (1.50)
16. Определение диаметра и высоты тарельчатой абсорбционной колонны проводится так же, как и для тарельчатых ректификационных колонн-см. гл. 2. Диаметр тарельчатого абсорбера рассчитывают по уравнениям (2.16) и (2.17). Высоту тарельчатой части абсорбера Нт определяют по уравнению (2.18). Требуемое число тарелок находят графически с применением кинетических зависимостей для расчета коэффициентов массопередачи или ВЕП. При приближенных расчетах для определения числа тарелок находят графически число ступеней изменения концентрации (рис. 1.4) и затем число тарелок n по уравнению (2.19).
Примеры
Пример 1.1. Жидкая смесь содержит 58,8% (мол.) толуола и 41,2% (мол.) четыреххлористого углерода (ч. х. у.). Определить относительную массовую концентрацию толуола `X (в кг толуола/кг ч. х. у.) и его объемную массовую концентрацию `Сx (в кг/м3).
Р е ш е н и е. Относительная массовая концентрация толуола:
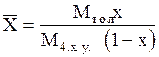 ,
,
где Мтол- мольная масса толуола (92 кг/кмоль); Мч.х.у.- то же четыреххлористого углерода (154 кг/кмоль); x - мольная доля толуола.
Имеем:
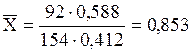 кг толуола/кг ч. х. у.
кг толуола/кг ч. х. у.
Чтобы рассчитать объемную массовую концентрацию толуола `Сx, необходимо знать плотность смеси rсм. Для расчета плотности предварительно найдем массовую долю толуола `x.
По табл. 1.2:
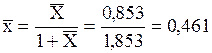 .
.
Далее по табл. IV находим: плотность толуола rтол=870 кг/м3, плотность четыреххлористого углерода rч.х.у.=1630 кг/м3.
Считая, что изменение объема при смешении не происходит, т. е. объем смеси равен сумме объемов компонентов, находим объем одного кг смеси
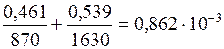 м3,
м3,
откуда плотность смеси:
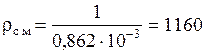 кг/м3.
кг/м3.
Можно рассчитать rсм и так:
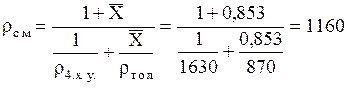 кг/м3.
кг/м3.
Объемная массовая концентрация толуола:
`Сx=r`x=1160×0,461=535 кг/м3.
Пример 1.2. Воздух атмосферного давления при температуре 34°С насыщен водяным паром. Определить парциальное давление воздуха, объемный и массовый % пара в воздушно-паровой смеси и его относительную массовую концентрацию, считая оба компонента смеси идеальными газами. Атмосферное давление 745 мм рт. ст. Определить также плотность воздушно-паровой смеси, сравнить ее с плотностью сухого воздуха.
Р е ш е н и е. По табл XXXVIII находим, что при t= 34°C давление насыщенного водяного пара составляет 39,9 мм рт. ст. Это давление является парциальным давлением водяного пара рп в воздушно-паровой смеси, а парциальное давление воздуха равняется:
pв=П - pп=745-39,9 » 705 мм рт. ст.
Мольная (объемная) доля водяного пара в меси:
y=pп/П=39,9/745=0,0535.
Массовая доля пара:
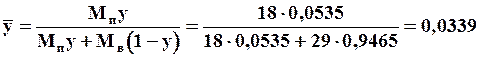
Относительная массовая концентрация
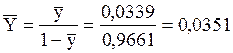 кг пара/кг воздуха.
кг пара/кг воздуха.
Плотность воздушно-паровой смеси рассчитываем как сумму плотностей компонентов, взятых каждая при своем парциальном давлении:
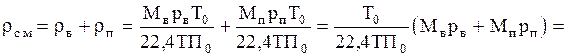
= 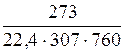 =(29×705+18×39,9)=1,105 кг/м3.
=(29×705+18×39,9)=1,105 кг/м3.
Можно рассчитать плотность смеси иначе.
Мольная масса смеси:
Мсм=Мпy+Мв(1-y)=18×0,0535+29×0,9465=28,4 кг/кмоль.
Плотность смеси при П=745 мм рт. ст. и t=34°C:
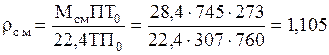 кг/м3
кг/м3
Плотность сухого воздуха при тех же давлении и температуре:
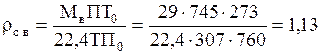 кг/м3.
кг/м3.
Пример 1.3. При температуре 25°С приведены в соприкосновение: воздух атмосферного давления, содержащий 14% (об.) ацетилена (С2Н2), и вода, содержащая растворенный ацетилен в количестве: а) 0,29×10-3 кг на 1 кг воды; б) 0,153×10-3 кг на 1 кг воды. Определить: 1) из какой фазы в какую будет переходить ацетилен; 2) движущую силу этого процесса перехода в начальный момент времени (в относительных мольных концентрациях). Атмосферное давление 765 мм рт. ст. Равновесные концентрации ацетилена в газовой и в жидкой фазах определяются законом Генри.
Р е ш е н и е. Закон Генри [уравнение (1.2)]:
p*=Еx.
По табл, XLI находим, что при t=25°С коэффициент Генри Е=1,01×106 мм рт. ст.
Парциальное давление ацетилена в воздухе по уравнению (1.1):
p=yП=0,14×765=107 мм рт. ст.
а) Мольная доля ацетилена в воде при `X=0,29×10-3кг ацетилена/кг воды (табл. 1.2):
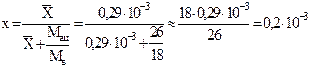 .
.
Ответы на вопросы примера могут быть получены двумя путями.
I. В условиях равновесия парциальное давление ацетилена в газовой фазе над жидкостью с x=0,2×10-3 по закону Генри должно составлять:
p*=Еx=1,01×106×0,2×10-3=202 мм рт. ст.
Имеющееся в действительности над этой жидкостью парциальное давление ацетилена меньше: p=107 мм рт. ст. Чтобы в процессе массопередачи система газ-жидкость приближалась к состоянию равновесия, парциальное давление ацетилена в газовой фазе должно увеличиваться, т. е. он будет переходить из воды в воздух.
Движущая сила этого процесса перехода (отклонение от состояния равновесия) в начальный момент времени будет равна: в единицах парциального давления ацетилена
Dp=p*-p=202-107=95 мм рт. ст.
в мольных долях
Dy=y*-y= 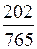 -0,14=0,264-0,14=0,124;
-0,14=0,264-0,14=0,124;
в относительных мольных концентрациях
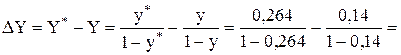
=0,359-0,163=0,196 кмоль ацетилена/кмоль воздуха.
II. В условиях равновесия с газовой фазой, в которой парциальное давление ацетилена равняется 107 мм рт. ст., вода по закону Генри должна иметь концентрацию ацетилена (в мольных долях):
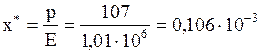 .
.
Имеющаяся в действительности мольная доля ацетилена в воде больше: x=0,2×10-3. Для того чтобы в процессе массоперехода система приближалась к состоянию равновесия, мольная доля ацетилена в воде должна уменьшаться, т. е. ацетилен будет переходить из воды в воздух.
Движущая сила этого процесса перехода в начальный момент времени (считая ее по концентрации в жидкой фазе):
в мольных долях
Dx=x-x*=0,2×10-3-0,106×10-3=0,094×10-3;
в относительных мольных концентрациях
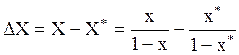 .
.
Так как в данном примере x и х* оба много меньше единицы, то в знаменателях последнего уравнения ими можно пренебречь и
DX=x-x*=0,094×10-3кмоль ацетилена/кмоль воды.
б) Мольная доля ацетилена в воде:
х » 18×0,153×10-3/26=0,106×10-3.
Перехода ацетилена из одной фазы в другую не будет, так как соприкасающееся фазы находятся в равновесии:
x=x*=0,106×10-3, y=y*=0,14.
Пример 1.4. В массообменном аппарате, работающем под давлением рабс=3,1 кнс/см2, коэффициенты массоотдачи имеют следующие значения: by=1,07 кмоль/м2×ч(Dy=1), bx=22 кмоль/м2×ч(Dx=1). Равновесные составы газовой и жидкой фаз характеризуются законом Генри р*=0,08×106x. Определить: а) коэффициенты массопередачи Ку и Кх; б) во сколько раз диффузионное сопротивление жидкой фазы отличается от диффузионного сопротивления газовой фазы:
Р е ш е н и е. Приведем уравнени