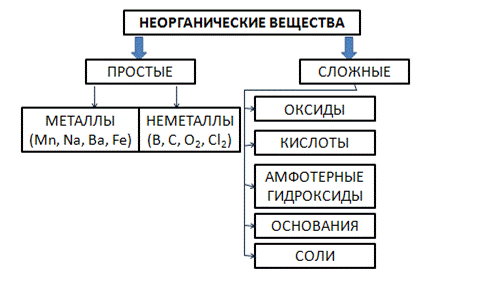
Классификация неорганических веществ
Неорганические вещества по составу принято делить на две группы: немногочисленную группу простых веществ (их насчитывается около 400) и очень многочисленную группу сложных веществ. Простые вещества состоят из одного химического элемента, а сложные – из нескольких.
Сложные вещества обычно делят на классы: оксиды, кислоты, основания, амфотерные гидроксиды и соли. Данная классификация несовершенна, т. к. в ней нет места для аммиака, соединений металлов с фосфором, азотом, углеродом и т. д.
 ______________________________________________
Оксиды
ОКСИДЫ– это сложные вещества, состоящие из двух химических элементов, один из которых - кислород.
______________________________________________
Оксиды
ОКСИДЫ– это сложные вещества, состоящие из двух химических элементов, один из которых - кислород.
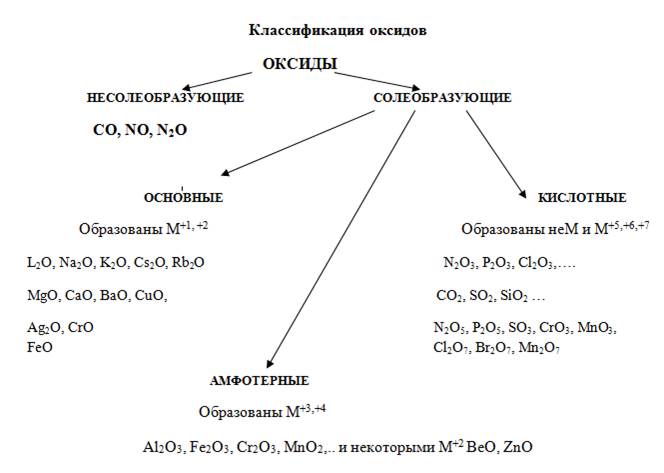
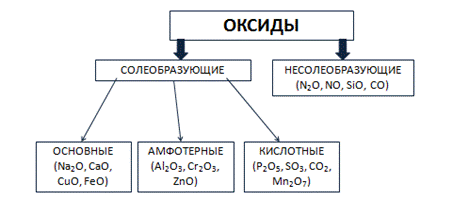 Оксиды могут быть солеобразующими и несолеобразующими. Солеобразующим оксидам соответствуют гидроксиды и соли с элементом в той же степени окисления, что и в оксиде. Несолеобразующие оксиды не имеют соответствующих гидроксидов и солей. Таких оксидов немного: N2O, NO, SiO, CO.
Солеобразующие оксиды в зависимости от кислотно-основного характера делятся на кислотные, амфотерные и основные.
Основные оксиды образованы металлами с небольшими степенями окисления +1, +2. Амфотерные оксиды образованы переходными металлами со степенями окисления +3, +4, а также Be, Zn, Sn, Pb. Кислотные оксиды образованы неметаллами, а также металлами со степенью окисления больше, чем +4. Рис. 3.
______________________________________________
Гидроксиды
Оксиды могут быть солеобразующими и несолеобразующими. Солеобразующим оксидам соответствуют гидроксиды и соли с элементом в той же степени окисления, что и в оксиде. Несолеобразующие оксиды не имеют соответствующих гидроксидов и солей. Таких оксидов немного: N2O, NO, SiO, CO.
Солеобразующие оксиды в зависимости от кислотно-основного характера делятся на кислотные, амфотерные и основные.
Основные оксиды образованы металлами с небольшими степенями окисления +1, +2. Амфотерные оксиды образованы переходными металлами со степенями окисления +3, +4, а также Be, Zn, Sn, Pb. Кислотные оксиды образованы неметаллами, а также металлами со степенью окисления больше, чем +4. Рис. 3.
______________________________________________
Гидроксиды
 ______________________________________________
Основания
ОСНОВАНИЯ – это сложные вещества, состоящие из ионов металла и гидроксид-ионов.
______________________________________________
Основания
ОСНОВАНИЯ – это сложные вещества, состоящие из ионов металла и гидроксид-ионов.
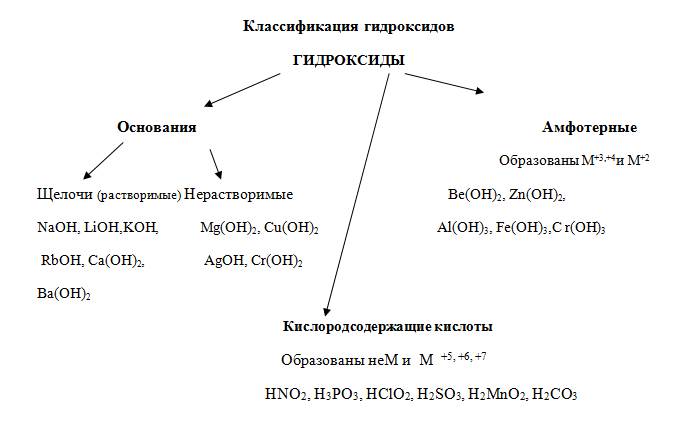
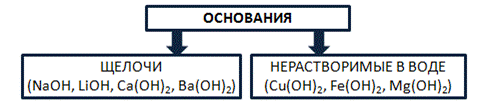 Основания – это сложные вещества, состоящие из катионов металла и одного или нескольких гидроксид-анионов. В основу классификации оснований могут быть положены разные признаки. Например, их отношение к воде. По данному признаку основания делят на растворимые в воде (щелочи) и нерастворимые в воде.
______________________________________________
Амфотерные гидроксиды
это сложные вещества, которые имеют свойства и кислот, и оснований, и потому их формулы можно записывать в разных формах:
Zn(OH)2 = H2ZnO2
форма основания форма кислоты
______________________________________________
Кислоты
КИСЛОТЫ– это сложные вещества, состоящие из ионов водорода и кислотных остатков.
Основания – это сложные вещества, состоящие из катионов металла и одного или нескольких гидроксид-анионов. В основу классификации оснований могут быть положены разные признаки. Например, их отношение к воде. По данному признаку основания делят на растворимые в воде (щелочи) и нерастворимые в воде.
______________________________________________
Амфотерные гидроксиды
это сложные вещества, которые имеют свойства и кислот, и оснований, и потому их формулы можно записывать в разных формах:
Zn(OH)2 = H2ZnO2
форма основания форма кислоты
______________________________________________
Кислоты
КИСЛОТЫ– это сложные вещества, состоящие из ионов водорода и кислотных остатков.
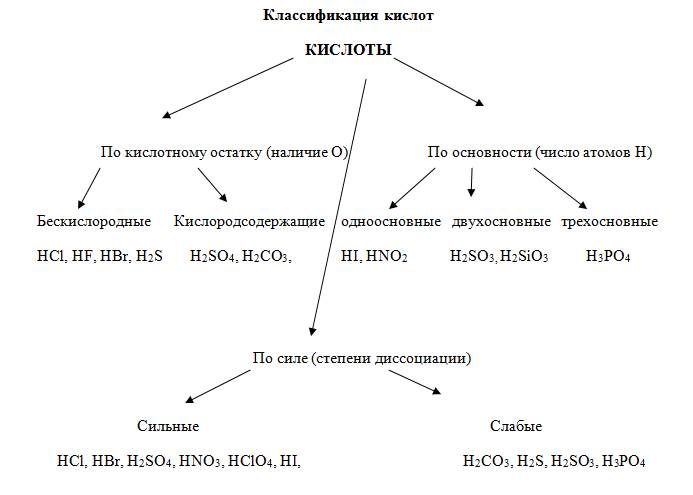
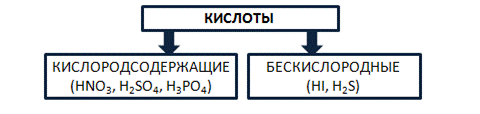 Кислоты – это сложные вещества, состоящие из атомов водорода, способных замещаться на металлы, и кислотных остатков. Кислоты можно разделить на группы по содержанию кислорода: кислородосодержащие (например, HNO3, H2SO4, H3PO4) и бескислородные (HI, H2S).
Кислоты – это сложные вещества, состоящие из атомов водорода, способных замещаться на металлы, и кислотных остатков. Кислоты можно разделить на группы по содержанию кислорода: кислородосодержащие (например, HNO3, H2SO4, H3PO4) и бескислородные (HI, H2S).
|
Соли. Названия и классификация солей.
Солями называются вещества, в которых атомы металла связаны с кислотными остатками.
Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+. Примеры типичных солей приведены ниже.
NaCl – хлорид натрия,
Na2SO4 – сульфат натрия,
СаSO4 – сульфат кальция,
СаCl2 – хлорид кальция,
(NH4)2SO4 – сульфат аммония.
Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток. Названия солей в зависимости от кислотного остатка показаны в таблице 8-6.
Таблица 8-6. Построение названий солей. В верхней части таблицы приведены кислородсодержащие кислотные остатки, в нижней – бескислородные.
| Соль какой кислоты | Кислотный остаток | Валентность остатка | Название солей | Примеры |
| Азотная HNO3 | NO3- | I | нитраты | Ca(NO3)2 нитрат кальция |
| Кремниевая H2SiO3 | SiO32- | II | силикаты | Na2SiO3 силикат натрия |
| Серная H2SO4 | SO42- | II | сульфаты | PbSO4 сульфат свинца |
| Угольная H2CO3 | CO32- | II | карбонаты | Na2CO3 карбонат натрия |
| Фосфорная H3PO4 | PO43- | III | фосфаты | AlPO4 фосфат алюминия |
| Бромоводородная HBr | Br- | I | бромиды | NaBr бромид натрия |
| Иодоводородная HI | I- | I | иодиды | KI иодид калия |
| Сероводородная H2S | S2- | II | сульфиды | FeS сульфид железа (II) |
| Соляная HCl | Cl- | I | хлориды | NH4Cl хлорид аммония |
| Фтороводородная HF | F- | I | фториды | CaF2 фторид кальция |
Из таблицы 8-6 видно, что названия кислородсодержащих солей имеют окончания " ат ", а названия бескислородных солей – окончания " ид ".
В некоторых случаях для кислородсодержащих солей может использоваться окончание " ит ". Например, Na2SO3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (H2SO4) и сернистой кислоты (H2SO3) и в других таких же случаях.
** Все соли разделяются на средние, кислые и основные. Средние соли содержат только атомы металла и кислотного остатка. Например, все соли из таблицы 8-6 являются средними солями.
Любую соль можно получить соответствующей реакцией нейтрализации. Например, сульфит натрия образуется в реакции между сернистой кислотой и основанием (едким натром). При этом на 1 моль кислоты требуется взять 2 моля основания:
| H2SO3 | + | 2 NaOH | = | Na2SO3 | + | 2 H2O |
| сульфит натрия (средняя соль) |