Модуль IV
Тема занятия №2: “ Стереоизомерия биологически активных поли-, гетерофункциональных и высокомолекулярных органических соединений”
Цель занятия: Научиться определять вид изомерии; отличать конформационный и конфигурационный стереоизомер; уметь объяснять оптическую активность органического соединения; определять число оптических изомеров; давать названия рацематам.
Студент должен знать:
- сущность явления изомерии;
- виды изомерии;
- сущность явления оптической изомерии;
- особенности и различия изомеров, таутомеров, конформеров и энантиомеров.
Студент должен уметь:
- определять вид изомерии;
- асимметрический атом в соединении;
- отличить конформационный и конфигурационный стереоизомер;
- давать определение рацемату;
- объяснить отсутствие оптической активности у данного соединения.
Изомерия – это существование веществ, имеющих одинаковый качественный и количественный состав, но различное строение.
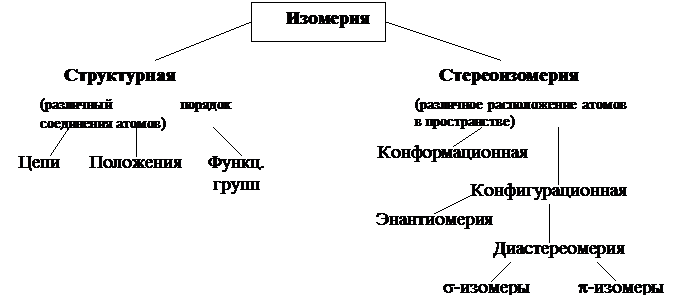
Структурная изомерия
Она делится:
1) Изомерия цепи
| С4Н10 | СН3 – СН2 – СН2 – СН3 | 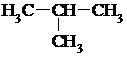
|
| Бутан | 2-Метилпропан |
2) Изомерия положения кратной связи и функциональных групп
| С4Н8 | СН2 = СН – СН2 – СН3 | СН3 – СН = СН – СН3 |
| Бутен-1 | Бутен-2 | |
| С3Н7ОН | СН3 – СН2 – СН2 – ОН | 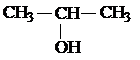
|
| Пропанол-1 | Пропанол-2 |
3) Изомерия функциональных групп (межклассовая изомерия)
| С3Н6О | 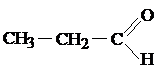
| 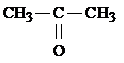
|
| Пропаналь | Пропанон-2 |
Пространственная изомерия (стереоизомерия)
Пространственное строение молекул связано со стереоспецифичностью биохимических процессов. Стереоспецифичность процессов, протекаюших в организме, состоит в том, что в реакцию вовлекаются определенные стереоизомеры и результатом реакции являются также стереохимически определенные продукты. Многие лекарственные вещества проявляют фармакологический эффект при взаимодействии с рецепторами клетки только в определенной форме, т. к. для этого необходимо, чтобы молекула лекарственного вещества имела такую конфигурацию, которая позволяла бы наиболее полно связываться с рецептором. Изменение конфигурации на противоположную, как правило, снижает степень связывания и ослабляет биологическое действие.
Итак, биологическое действие биорегуляторов (гормоны, витамины, антибиотики и др.) лекарственных веществ принципиально связано с пространственным строением их молекул.
Конформационная изомерия
К динамическому ряду пространственных изомеров относятся конформационные изомеры, или конформации.
Конформационными называются изомеры, молекулы которых переходят друг в друга за счет свободного вращения атомов и групп атомов вокруг одной или нескольких s-связей.
Появление коформаций связано с тем, что хотя вокруг одинарной связи должно быть свободное вращение, однако вследствие взаимного отталкивания атомов и групп атомов существует некоторый энергетический барьер, который необходимо преодолеть для осуществления такого свободного вращения.
Для изображения конформаций используют проекции Ньюмена.
Конформации, обладающие минимумом энергии и наиболее стабильные по этой причине, называются конформерами.
Различают для соединений с открытой цепью (например, для этана) заторможенную, заслоненную и скошенную конформации. Для циклических соединений (например, для циклогексана) - конформации "кресла" и "ванны". Энергетически выгодными являются заторможенная конформация и конформация "кресла".

 С2Н6
С2Н6
 |  | |||||
Заслонённая конформация Заторможенная конформация
 более энергетически выгодная
более энергетически выгодная
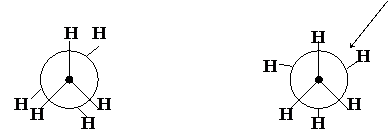 | |||||
 |  |
Формулы Ньюмена
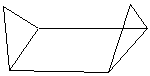
С6Н12
Циклогексан
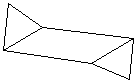
| 
|
| «Кресло» | «Ванна» |
Форма «кресла» более энергетически выгодна, чем «ванна».
Конфигурационная изомерия.
Конфигурационными изомерами называются стереоизомеры, молекулы которых имеют различное расположение атомов в пространстве без учета конформаций.
По типу симметрии все стереоизомеры делятся на энантиомеры и диастереомеры.
В 1915 году французский физик Ж.-Б. Био открыл явление оптической активности - способности жидкостей вращать плоскость поляризации плоскополяризованного света. Оптическую активность измеряют приборами, которые называются поляриметрами. Монохроматический свет, пройдя через поляризатор (призма Николя из исландского шпата), становится поляризованным. Если в прибор поместить раствор с оптически активным веществом, то поляризованный свет приобретает плоскость поляризации, смещенную на угол a.(измеряется в градусах).
В 1948 году Л. Пастер, отделив пинцетом друг от друга кристаллы двух зеркальных форм оптически неактивной натрий-аммониевой соли виноградной кислоты, получил из неактивной смеси оптически активные вещества. Оба изомера смещали плоскость поляризации поляризованного света на один и тот же угол, но в разные стороны: один - по часовой стрелке (правовращающий, "+"), другой - против часовой стрелки (левовращающий, "-"). Так впервые были получены право- и левовращающие винные кислоты из неактивной виноградной кислоты. Эти изомеры были названы оптическими антиподами, или оптическими изомерами.
Равная смесь право- и левовращающих изомеров одного соединения называется рацематом, она оптически неактивна.
Энантиомеры (оптические изомеры, зеркальные изомеры, антиподы)- это стереоизомеры, молекулы которых относятся друг к другу как предмет и несовместимое с ним зеркальное отображение. Это явление называется энантиомерией.
Энантиомерами являются только те соединения, в которых содержится один или несколько асимметрических (хиральных) атомов углерода.
Асимметрическим (хиральным) является атом, у которого выполняются следующие условия: 1) sp3 гибридное состояние, 2) все четыре заместителя разные.
Все физические и химические свойства энантиомеров одинаковы, кроме вращения плоскости поляризации плоскополяризованного света и биологической активности.
Поляриметр позволяет определить только знак вращения, но не указывает, какой конкретно энантиомер имеет такое вращение. Для этого необходимо установить абсолютную конфигурацию, то есть истинное расположение заместителей в пространстве относительно хирального центра. Определяют абсолютную конфигурацию сложными физико-химическими методами. После выяснения абсолютных конфигураций нескольких соединений появилась возможность характеризовать все остальные путем сравнения их конфигураций с конфигурациями эталонных соединений, то есть определить относительные конфигурации.
В качестве стандарта М.А. Розанов в 1906 г. предложил "+"-глицериновый альдегид, которому условно приписали D-конфигурацию, а его антиподу левовращающему изомеру L-конфигурацию, то есть следующее расположение заместителей:
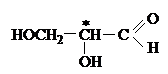 | |||
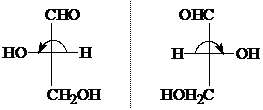 | |||
L-ряд D-ряд
Для изображения конфигурационных изомеров пользуются формулами Фишера. Хиральный центр рисуют с четырьмя связями, расположенными под прямым углом друг к другу. Вертикальные линии изображают заместителей, находящихся за плоскостью листа бумаги, горизонтальные - над плоскостью, центральный атом находится в плоскости листа. Асимметрический (хиральный) атом часто помечают звездочкой *.
К D-стереохимическому ряду относят родственные D-глицериновому альдегиду соединения с аналогичной конфигурацией центра хиральности, к L-ряду аналогично конфигурации L-глицеринового альдегида.
Важно отметить, что знак вращения не имеет прямой связи с конфигурацией.
Количество изомеров определяют по формуле:
N=2n, где N-число изомеров,
n-число хиральных атомов углерода
Среди энантиомеров могут быть симметричные молекулы, не обладаюшие оптической активностью, называются они мезоизомерами.
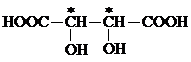 |
| Например: Винная к-та | |||
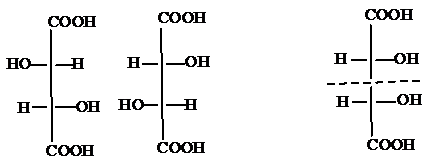
| |||
| D – (+) – ряд L – (–) – ряд | Мезовинная к-та |
Рацемат – виноградная к-та
s-Диастереомерия.
Оптические изомеры, не являющиеся зеркальными изомерами, отличающиеся конфигурацией нескольких, но не всех асимметрических атомов углерода, обладающие различными физическими и химическими свойствами, называются s-диастереомерами.
Например, 2-гидрокси-3-хлорбутановая кислота имеет 4 изомера:

I и II, III и IV – энантиомеры:
I и III, I и IV, II и III, II и IV – диастереомеры.
Таким образом, в зависимости от расположения атомов в пространстве могут быть различные пространственные изомеры, обладающие биологической активностью.
P-Диастереомерия.
p-Диастереомеры (геометрические изомеры) – это стереомеры, имеющие в молекуле p-связь. Они встречаются у алкенов, непредельных высших карбоновых к-т, непредельных дикарбоновых к-т
Биологическая активность органических вещ-в связана с их строением.
Например:
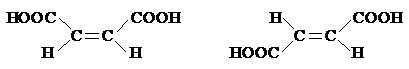
Цис-бутендиовая к-та, Транс-бутендиовая к-та,
малеиновая к-та – фумаровая к-та – не ядовита,
очень ядовита содержится в организме
Все природные непредельные высшие карбоновые к-ты являются цис-изомерами.
Вопросы для самоконтроля:
1. Что такое изомерия (понятие)? Виды изомерии.
2. Структурная изомерия.
3. Конформационная изомерия.
4. Конфигурациооная изомерия: энантиомерия, диастереомерия.
5. Причины проявления органическими молекулами оптической изомерии? Хиральные молекулы, ассиметрический атом углерода. Абсолютная и относительная конфигурации. D- и L-стереоизомерические ряды. Рацематы.
6. p-Диастереомеры (цис- и транс-изомеры).
7. Единство структуры, конфигурации и конформации органических
соединений. Связь между пространственным строением и биологической активностью (фумаровая и малеиновая кислоты).
8. Напишите структурные формулы изомерных оксикислот состава С5Н10О3. Укажите изомеры углеродного скелета и положения.
9. Напишите структурные формулы изомерных аминокислот состава С5Н11NО2. Укажите изомеры, содержащие третичный атом углерода.
10. Приведите проекционную формулу Фишера для D-2-гидроксибутандиовой кислоты. Как определяется знак вращения для соединения.
11. Изобразите при помощи формулы Фишера структуру L-изомера для 3-гидроксибутановой кислоты.
12. Для каких соединений характерно существование цис- и транс-изомеров. Изобразите их:
а) 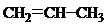 , б)
, б) 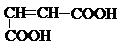 , в)
, в) 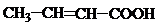 .
.